
Wetenschap
Hoe dimmerisatie van borane kan worden verklaard door resonantie?
Borane's (BH₃) instabiliteit:
* Elektrontekort: Borane heeft slechts 6 valentie -elektronen rond het booratoom, waardoor het elektronentekst is.
* Hoge reactiviteit: Dit tekort maakt Borane zeer reactief, vatbaar voor het vormen van dimeren om een stabielere elektronenconfiguratie te bereiken.
de structuur en stabiliteit van Diborane (B₂h₆):
* 3-center, 2-elektronenbindingen: Diborane beschikt over twee overbruggende waterstofatomen (B-H-B) die betrokken zijn bij "bananen" -bindingen. Elk overbruggende waterstofatoom interageert met beide booratomen, waardoor een 3-center, 2-elektronenbinding ontstaat.
* Resonantiestabilisatie: Deze bananenbindingen kunnen worden afgebeeld door twee resonantiestructuren, waarbij de overbruggende waterstofatomen worden geassocieerd met verschillende booratomen. Deze resonantie draagt bij aan de algehele stabiliteit van het molecuul.
Resonantiestructuren:
Hier is een vereenvoudigde weergave van de resonantiestructuren van Diborane:
`` `
H H H
| | |
B - H - B <=> B - H - B
| | |
H H H
`` `
Betekenis van resonantie:
* Verhoogde elektronendichtheid: De resonantiestructuren verdelen de elektronendichtheid over beide booratomen, waardoor het elektroneficiëntie gedeeltelijk wordt verlicht.
* stabilisatie van de overbruggende waterstofbruggen: De resonantie structuren delocaliseren de elektronendichtheid in de 3-center, 2-elektronenbindingen, wat bijdraagt aan hun stabiliteit.
Over het algemeen, hoewel de primaire stuurprogramma voor boraandimerisatie de elektroneficiëntie is, speelt resonantie een sleutelrol bij het verklaren van de stabiliteit van het resulterende diboraanmolecuul door de vorming van bananenbindingen en hun delocalisatie.
 Wat is natuurlijke vervuiling?
Wat is natuurlijke vervuiling?  Hoe de agrifoodindustrie de vernieuwing van de Canadese Food Guide probeerde te beïnvloeden
Hoe de agrifoodindustrie de vernieuwing van de Canadese Food Guide probeerde te beïnvloeden  Waar is het zee-ijs? 3 redenen waarom de Arctische bevriezing ongebruikelijk laat is en waarom het ertoe doet
Waar is het zee-ijs? 3 redenen waarom de Arctische bevriezing ongebruikelijk laat is en waarom het ertoe doet Copernicus legt beeld vast van de Republiek der Maldiven
Copernicus legt beeld vast van de Republiek der Maldiven Hoe beïnvloeden temperatuurinversies de luchtvervuiling?
Hoe beïnvloeden temperatuurinversies de luchtvervuiling?
Hoofdlijnen
- Samenstelling van de celwand van de zes koninkrijken
- Waarom is het belangrijk om objecten in de wetenschap te classificeren en te groeperen?
- In het blauw:hoe baleinwalvissen zich de afgelopen 50 miljoen jaar hebben aangepast
- Welke soorten cellen delen door mitose en cytokinese?
- Wat zijn KMEF -eiwitten?
- Welke van de bloedcellen maken stolsel?
- Wat is de lengte en breedte van de prokaryotische cel?
- Is Typhiod een desase of sterke wind?
- Welke factor is het minst belangrijk om het plantenleven een bioom te bepalen?
- Wetenschappers hebben nieuwe verbindingen ontdekt met herbicide potentieel van zeeschimmel

- Nieuwe katalyse met één atoom zorgt voor reductieve amineringsreactie
- De geur van gerecycled plastic opsporen

- Onderzoekers onderzoeken signaaloverdracht in eiwitten over meerdere tijdschalen
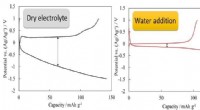
- Structuur van elektrolyt regelt batterijprestaties
 Superlichte dempers voor lage tonen
Superlichte dempers voor lage tonen Is ammoniumnitraat oplosbaar in cyclohexaan?
Is ammoniumnitraat oplosbaar in cyclohexaan?  Tupperware schiet voor de sterren met een apparaat dat bedoeld is om groenten in de ruimte te verbouwen
Tupperware schiet voor de sterren met een apparaat dat bedoeld is om groenten in de ruimte te verbouwen Belangrijkste bewijsmateriaal dat hydrofobiciteit associeert met effectieve zuurkatalyse
Belangrijkste bewijsmateriaal dat hydrofobiciteit associeert met effectieve zuurkatalyse Een thermometer die kan worden uitgerekt en vervormd door water
Een thermometer die kan worden uitgerekt en vervormd door water Uit onderzoek blijkt dat wereldwijde actie nodig is om aanvaardbare klimaattoekomsten te verzekeren
Uit onderzoek blijkt dat wereldwijde actie nodig is om aanvaardbare klimaattoekomsten te verzekeren Onderzoekers ontdekken kritische metabole schakelaar voor ontstekingsziekten
Onderzoekers ontdekken kritische metabole schakelaar voor ontstekingsziekten Welk type chemische binding is chroomsulfaat?
Welk type chemische binding is chroomsulfaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

