
Wetenschap
Waarom heeft aluminium een hoger smeltpunt dan natrium?
1. Metallic binding: Zowel aluminium als natrium vertonen metalen binding, waarbij elektronen worden gedelokaliseerd en gedeeld door het metalen rooster. De sterkte van deze binding verschilt echter aanzienlijk.
2. Aantal valentie -elektronen: Aluminium heeft drie valentie -elektronen, terwijl natrium er maar één heeft. Dit betekent dat aluminium meer elektronen beschikbaar heeft voor delocalisatie, wat bijdraagt aan sterkere metalen binding.
3. Atomic Grootte: Aluminiumatomen zijn kleiner dan natriumatomen. Deze nadere nabijheid tussen de positief geladen kernen en de delocaliseerde elektronen resulteert in sterkere elektrostatische attracties, waardoor de metallische binding verder wordt versterkt.
4. Kristalstructuur: Aluminium heeft een gezichtsgerichte kubieke (FCC) kristalstructuur, die nauwer is verpakt dan de lichaamsgerichte kubieke (BCC) structuur van natrium. Deze nauwere verpakking verbetert de sterkte van de metalen bindingen.
Samenvattend:
* sterkere metalen binding: De sterkere metalen binding van aluminium, vanwege een groter aantal valentie -elektronen, kleinere atoomgrootte en een beter gepakte kristalstructuur, leidt tot een hoger smeltpunt.
* zwakkere metalen binding: Natriums zwakkere metalen binding, vanwege een minder aantal valentie -elektronen, grotere atoomgrootte en een minder nauw gepakte structuur, resulteert in een lager smeltpunt.
Daarom verklaart de combinatie van deze factoren waarom aluminium een aanzienlijk hoger smeltpunt heeft dan natrium.
 Wat voor soort molecuul wordt gevormd als alles wat hij atomen in een gelijke aantrekkingskracht op de gedeelde elektronen heeft?
Wat voor soort molecuul wordt gevormd als alles wat hij atomen in een gelijke aantrekkingskracht op de gedeelde elektronen heeft?  Heeft het om een vloeistof te laten gas worden, heeft het 100 graden Celsius bereikt?
Heeft het om een vloeistof te laten gas worden, heeft het 100 graden Celsius bereikt?  De vijf basisstoffen die betrokken zijn bij de rotscyclus?
De vijf basisstoffen die betrokken zijn bij de rotscyclus?  Wat zijn voor- en nadelen van ijzers metalen?
Wat zijn voor- en nadelen van ijzers metalen?  Wat is de meest zure pH 10 3 2 6 8 12 1 75?
Wat is de meest zure pH 10 3 2 6 8 12 1 75?
Hoofdlijnen
- Wat is het eerste organisme in de aarde?
- Commensalisme:ik profiteer,
- Onderbroken herprogrammering zet volwassen cellen om in hoge opbrengsten van voorloperachtige cellen
- Wilde megalopolis:onderzoek toont onverwachte gebieden met biodiversiteitspeper Los Angeles
- Waarom worden ze omega-3-vetzuren genoemd?
- Krijgen enzymen hulp van cofactoren?
- Wanneer wordt het inwendige van de cel als isotoon met de omringende vloeistof beschouwd?
- Hoe wordt de studie van mensen genoemd?
- Organismen die groeien op plantaardige materialen en voedsel absorberen zijn?
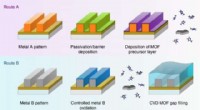
- Nieuwe isolatietechniek maakt de weg vrij voor krachtigere en kleinere spanen
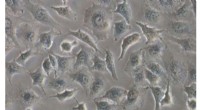
- Onderzoekers gebruiken hele levende cellen als sjablonen om naar bioactieve moleculen te zoeken
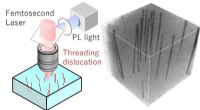
- Niet-destructieve karakteriseringstechniek helpt bij de ontwikkeling van galliumnitridekristallen
- Hoe water het substraat in het enzym helpt

- Genenschaar gebruiken om ziekten op te sporen

 Zal een katalysator de reactie van de reactie in de chemische reactie veranderen?
Zal een katalysator de reactie van de reactie in de chemische reactie veranderen?  Deens rechtssysteem opgeschrikt door gebrekkig bewijs van telefoonlocatie
Deens rechtssysteem opgeschrikt door gebrekkig bewijs van telefoonlocatie Is er zon op de maan?
Is er zon op de maan?  Hoe een 3D-model van Glucose
Hoe een 3D-model van Glucose Belangrijk verschil in hoe tbc-bacteriën gedoemde eiwitten afbreken
Belangrijk verschil in hoe tbc-bacteriën gedoemde eiwitten afbreken  Tropische storm Eta overstromingen al doordrenkte steden in Florida
Tropische storm Eta overstromingen al doordrenkte steden in Florida Het thermisch beheer van elektronische apparaten is eenvoudiger en iets beter gemaakt
Het thermisch beheer van elektronische apparaten is eenvoudiger en iets beter gemaakt  Kwantumsystemen leren gezamenlijk computergebruik
Kwantumsystemen leren gezamenlijk computergebruik
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

