
Wetenschap
Hoe berekent u hoeveel zuurstofatomen er zijn in 2,50 gram gas?
* Verschillende gassen, verschillende zuurstofgehalte: Het aantal zuurstofatomen in een bepaalde massa hangt af van de moleculaire formule van het gas. Bijvoorbeeld:
* zuurstofgas (o₂): Elk molecuul heeft twee zuurstofatomen.
* koolstofdioxide (co₂): Elk molecuul heeft twee zuurstofatomen.
* waterdamp (h₂o): Elk molecuul heeft één zuurstofatoom.
Hier is hoe u het aantal zuurstofatomen berekent als u het gas kent:
1. Bepaal de moleculaire formule van het gas. Dit vertelt u hoeveel zuurstofatomen er in elk molecuul zijn.
2. Bereken de molaire massa van het gas. Dit is de massa van één mol van het gas, uitgedrukt in gram per mol (g/mol).
3. Converteer de massa van het gas in mol. Verdeel de massa van het gas door zijn molaire massa.
4. Vermenigvuldig het aantal mol met het nummer van Avogadro. Dit geeft u het aantal moleculen van het gas.
5. Vermenigvuldig het aantal moleculen met het aantal zuurstofatomen per molecuul. Dit geeft u het totale aantal zuurstofatomen.
Voorbeeld:
Stel dat u 2,50 gram koolstofdioxide (CO₂) heeft.
1. Moleculaire formule: Co₂ (2 zuurstofatomen per molecuul)
2. Molaire massa van co₂: 44.01 g/mol (12,01 g/mol voor C + 2 * 16,00 g/mol voor O)
3. mol Co₂: 2,50 g / 44.01 g / mol =0,0568 mol
4. Aantal CO₂ -moleculen: 0,0568 mol * 6.022 x 10²³ Moleculen/mol =3,42 x 10²² moleculen
5. Aantal zuurstofatomen: 3,42 x 10²² moleculen * 2 zuurstofatomen/molecuul =6,84 x 10²² zuurstofatomen
Daarom zijn er ongeveer 6,84 x 10²² zuurstofatomen in 2,50 gram koolstofdioxide.
 Een boom planten en de aarde redden?
Een boom planten en de aarde redden?  Wat drijft de enorme bloemen van bruin zeewier die zich opstapelen op de stranden van Florida en de Caraïben?
Wat drijft de enorme bloemen van bruin zeewier die zich opstapelen op de stranden van Florida en de Caraïben? Minder plastic in tuinen
Minder plastic in tuinen Is rundvlees de nieuwe steenkool? Klimaatvriendelijk eten zit in de lift
Is rundvlees de nieuwe steenkool? Klimaatvriendelijk eten zit in de lift Plasticvervuiling:kunnen we de oceaan opruimen met technologie?
Plasticvervuiling:kunnen we de oceaan opruimen met technologie?
Hoofdlijnen
- Waar staat het gaea-gedeelte van Pangaea voor?
- Wat is het element om eiwitten te maken voor groei en reparatie?
- Welk molecuul bevat de erfelijke informatie voor een cel?
- Nieuwe structuren bieden inzicht in hoe een bacteriële motor chemotaxis, een belangrijk infectieus proces, aandrijft
- Wat is de functie van een gestreepte spiercel?
- Welke structuren geven vorm aan plantencellen?
- Hoe kleine genetische veranderingen bij Yersinia pestis de menselijke geschiedenis veranderden
- Welke factor maakte de evolutie langzaam voor de eerste twee miljard levensjaren op aarde?
- Waarom is het zo moeilijk voor mensen om een baby te krijgen?
- Onderzoekers werken aan systemen voor het opvangen van kooldioxide

- Nieuwe techniek zet ammoniak naadloos om in groene waterstof

- Techniek om functionele materialen te maken op basis van polymeren van metaalclusters
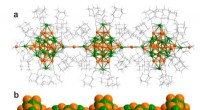
- Werkende eiwitten maken goed gebruik van frustratie
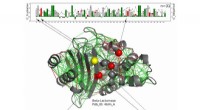
- Spinnen en mieren inspireren metaal dat niet zinkt

 Waarom vallen sommige objecten dan in een ander tempo door de lucht?
Waarom vallen sommige objecten dan in een ander tempo door de lucht?  Hoe hergebruikt de natuurmaterialen?
Hoe hergebruikt de natuurmaterialen?  Hoe weet je of een land serieus is over netto nul:kijk naar de plannen voor de winning van fossiele brandstoffen
Hoe weet je of een land serieus is over netto nul:kijk naar de plannen voor de winning van fossiele brandstoffen Hoe lichtmicroscopen werken
Hoe lichtmicroscopen werken  Wat je moet weten voordat je deze kerst een drone koopt
Wat je moet weten voordat je deze kerst een drone koopt  Zijn dierlijke cellen en planten dezelfde grootte?
Zijn dierlijke cellen en planten dezelfde grootte?  Wat zit er achter de turbulenties van Einstein? Berekeningen geven een eerste inzicht in de relativistische eigenschappen van dit proces
Wat zit er achter de turbulenties van Einstein? Berekeningen geven een eerste inzicht in de relativistische eigenschappen van dit proces  Montreal breekt temperatuurrecord in mei terwijl de hittegolf Canada in zijn greep houdt
Montreal breekt temperatuurrecord in mei terwijl de hittegolf Canada in zijn greep houdt
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

