
Wetenschap
De pH van een 0,01 m oplossing natriumacetaat berekenen?
1. Begrijp de chemie
* Natriumacetaat (nach₃coo) is het zout van een zwak zuur (azijnzuur, ch₃cooh) en een sterke basis (natriumhydroxide, NaOH).
* Wanneer natriumacetaat oplost in water, dissocieert het volledig in natriumionen (Na⁺) en acetaationen (ch₃coo⁻).
* De acetaationen zullen reageren met water in een evenwichtsreactie om hydroxide -ionen (OH⁻) en azijnzuur (CH₃COOH) te produceren, waardoor de oplossing enigszins basisch wordt.
2. Het evenwicht instellen
De relevante evenwichtsreactie is:
Ch₃coo⁻ (aq) + h₂o (l) ⇌ ch₃cooh (aq) + oh⁻ (aq)
3. Gebruik de KB -expressie
We moeten de basisdissociatieconstante (KB) gebruiken voor het acetaation om de hydroxide -ionenconcentratie te berekenen:
Kb =[ch₃cooh] [oh⁻] / [ch₃coo⁻]
* We kunnen de KB -waarde voor acetaat in een tabel vinden (zoek de KA op voor azijnzuur en gebruik de relatie KB * ka =kW, waarbij KW =1,0 x 10⁻¹⁴). De KB voor acetaat is ongeveer 5,6 x 10⁻¹⁰.
4. Zet een ijstafel op
We zullen een ijs (initiële, verandering, evenwicht) tabel gebruiken om de evenwichtsconcentraties te bepalen:
| | Ch₃coo⁻ | Ch₃cooh | Oh⁻ |
| ----------- | ---------- | ---------- | --------- |
| Eerste | 0,01 m | 0 | 0 |
| Verandering | -x | +x | +x |
| Evenwicht | 0.01 - x | X | X |
5. Oplossen voor x (de [oh⁻])
Vervang de evenwichtsconcentraties in de KB -expressie:
5.6 x 10⁻¹⁰ =(x) (x) / (0.01 - x)
Omdat KB erg klein is, kunnen we aannemen dat X veel kleiner is dan 0,01, dus we kunnen de vergelijking vereenvoudigen:
5.6 x 10⁻¹⁰ ≈ X² / 0.01
Oplossen voor x:
x² ≈ 5,6 x 10⁻¹²
x ≈ 2.37 x 10⁻⁶ m (dit is de [oh⁻])
6. Bereken poh
pOH =-log [oh⁻] =-log (2.37 x 10⁻⁶) ≈ 5.63
7. Bereken pH
pH + poh =14
pH =14 - POH =14 - 5.63 ≈ 8.37
Daarom is de pH van een oplossing van 0,01 M natriumacetaat ongeveer 8,37.
 Hoe wateropvangbijen weten wanneer ze de dorst van de hete bijenkorf moeten lessen
Hoe wateropvangbijen weten wanneer ze de dorst van de hete bijenkorf moeten lessen  Waarom was de basis van het classificatie -element in de periodieke tabel gewijzigd van atomaire massa naar aantal?
Waarom was de basis van het classificatie -element in de periodieke tabel gewijzigd van atomaire massa naar aantal?  Wat planten ons kunnen leren over het opruimen van olievlekken en microfluïdica
Wat planten ons kunnen leren over het opruimen van olievlekken en microfluïdica Wat gebeurt er wanneer magnesiumcarbonaat wordt gecalcineerd?
Wat gebeurt er wanneer magnesiumcarbonaat wordt gecalcineerd?  Wat is loodnitraat en ammoniumsulfaat?
Wat is loodnitraat en ammoniumsulfaat?
Hoofdlijnen
- Wat is het proces van het maken van een kopie -DNA voor doel -eiwitten?
- Als deze tanden konden praten:wat stond er werkelijk op het menu van onze voorouders?
- Kunnen vissen verkouden worden?
- Wat is een Erlenmeyer -kolf en zijn functie?
- Wat is de reden dat Parasite -schimmels hun gastheer kunnen doden en blijven bloeien?
- Waarom is de zon zo helder?
- Onderzoekers melden nieuwe varensoorten uit Yunnan, China
- Evolutie en ecologische concurrentie van meercellige levenscycli
- Wat moet u om bacteriën op appels te krijgen?
- Problemen met bellen vermijden:onderzoek naar de relatie tussen bellen en elektrochemie

- Cathinone-kleurtest is nu op de markt

- Succesvolle synthese van perovskiet zichtbaar lichtabsorberend halfgeleidermateriaal
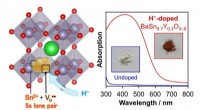
- Neutronen onderzoeken biologische materialen voor inzicht in COVID-19-virusinfectie
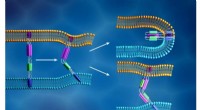
- Een nieuw paradigma van materiaalidentificatie op basis van grafentheorie
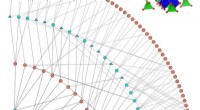
 Hoe zee-ijsafwijkingen in de Barentsz-Kara Zee worden gemoduleerd door het 'warme Arctische-koude Eurazië'-patroon
Hoe zee-ijsafwijkingen in de Barentsz-Kara Zee worden gemoduleerd door het 'warme Arctische-koude Eurazië'-patroon  Waarom bedrijven, banken en de samenleving nog steeds meer vrouwen in leidinggevende functies nodig hebben
Waarom bedrijven, banken en de samenleving nog steeds meer vrouwen in leidinggevende functies nodig hebben  Wat heeft de Daltons -theorie bijgedragen aan de wetenschap?
Wat heeft de Daltons -theorie bijgedragen aan de wetenschap?  Welk vroege compromis trok een denkbeeldige slavenlijn op 36 graden North Latitude om vrije staten te scheiden?
Welk vroege compromis trok een denkbeeldige slavenlijn op 36 graden North Latitude om vrije staten te scheiden?  Wat is de term voor component als een oplossing waarin een andere stof is opgelost?
Wat is de term voor component als een oplossing waarin een andere stof is opgelost?  Noem de ziekte waar bloedcellen niet genoeg zuurstof dragen?
Noem de ziekte waar bloedcellen niet genoeg zuurstof dragen?  De kleine ijstijd heeft de tropische regengordel verdrongen
De kleine ijstijd heeft de tropische regengordel verdrongen Wat is de helling van een constante snelheid?
Wat is de helling van een constante snelheid?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

