
Wetenschap
Wat is de beste weergave van solvatie, een natriumkation in water?
Solvatie begrijpen
Solvatie is het proces waarbij opgeloste deeltjes (zoals Na+) worden omgeven door oplosmiddelmoleculen (zoals water). Dit gebeurt vanwege aantrekkelijke krachten tussen de opgeloste stof en oplosmiddel.
Natriumkation (Na+) en water (H₂o)
* Na+: Heeft een positieve lading en trekt het negatieve uiteinde van watermoleculen (het zuurstofatoom) aan.
* h₂o: Heeft een gedeeltelijke negatieve lading op het zuurstofatoom en een gedeeltelijke positieve lading op de waterstofatomen vanwege de gebogen moleculaire vorm en polaire covalente bindingen.
Beste weergave
De beste weergave van solvatie van Na+ in water moet laten zien:
1. Natriumkation omgeven door watermoleculen: De Na+ moet in het midden zijn, omgeven door verschillende watermoleculen.
2. Zuurstofatomen tegenover Na+: De zuurstofatomen van de watermoleculen moeten naar de Na+ wijzen omdat ze worden aangetrokken door de positieve lading.
3. Waterstofatomen wijzen weg van Na+: De waterstofatomen van de watermoleculen zouden weg moeten wijzen van de Na+ omdat ze een gedeeltelijke positieve lading hebben.
Gemeenschappelijke visuele representaties
* Eenvoudig stokdiagram: Dit gebruikt lijnen om de bindingen in watermoleculen en een cirkel voor het Na+ -ion weer te geven. De zuurstofatomen moeten dicht bij het Na+ -ion worden geplaatst.
* Model voor ruimtevullen: Dit toont de relatieve afmetingen en vormen van de betrokken atomen, waardoor een realistischer beeld wordt gegeven van hoe de watermoleculen clusteren rond het Na+ -ion.
Belangrijke opmerking: Het exacte aantal watermoleculen rond NA+ hangt af van de specifieke omstandigheden (temperatuur, concentratie, enz.). Het algemene principe van de zuurstofatomen die dichter bij de Na+ en waterstofatomen die weg wijzen, blijft echter hetzelfde.
Laat het me weten als je een specifiek type diagram wilt beschrijven!
 Wat is een puur metaal gemengd met andere metalen die worden gebruikt om de hardheid en sterkte te verbeteren?
Wat is een puur metaal gemengd met andere metalen die worden gebruikt om de hardheid en sterkte te verbeteren?  Wat voor soort materialen zou koolstofdioxide beïnvloeden?
Wat voor soort materialen zou koolstofdioxide beïnvloeden?  Team ontwikkelt nieuwe halfgeleiderverwerkingstechnologie
Team ontwikkelt nieuwe halfgeleiderverwerkingstechnologie Burst een waterpijp de fysieke reactie of chemische reactie?
Burst een waterpijp de fysieke reactie of chemische reactie?  Kan water in de vaste en gasfase bestaan zonder dat er vloeistof aanwezig is?
Kan water in de vaste en gasfase bestaan zonder dat er vloeistof aanwezig is?
Hoofdlijnen
- Welke 2 dingen vormen alle celmembranen?
- Wat zijn enkele voorbeelden en niet-voorbeelden van multi-celled?
- Wat zijn de belangrijkste functionele kenmerken van alle organismen?
- Genen die samenkomen met verschillende allelen worden genoemd?
- Onderzoekers ontdekken hoe kleine suikers stamcellen reguleren
- Genotypes bepalen
- Wat is de rol van mRNA en tRNA in productie -eiwit?
- Hoe visvinnen evolueerden vlak voor de overgang naar land
- Wat is een systeem dat extracellulaire vloeistof verzamelt en het aan uw lichaam terugbrengt?
- Onderzoekers ontdekken eerste enzymen die een klassieke organische reactie katalyseren
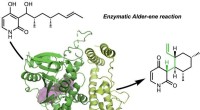
- Een chemisch functionele fosforversie van natuurlijk rubber
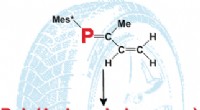
- Krachtige nieuwe beeldvormingsmethode onthult in detail hoe deeltjes in oplossing bewegen
- Bacteriën eten broeikasgas met een kant van eiwit

- Van recycling naar upcycling:slimmer omgaan met plastic
 Is de warmte van een verwarmingskussen een voorbeeldgeleiding?
Is de warmte van een verwarmingskussen een voorbeeldgeleiding?  Wat is gelijk aan 4 km?
Wat is gelijk aan 4 km?  De beste vriend van een vrouw - honden en huiselijk geweld
De beste vriend van een vrouw - honden en huiselijk geweld Heb je katoen? De ontdekking van onderzoekers uit Texas zou eiwitten kunnen opleveren om miljoenen mensen te voeden
Heb je katoen? De ontdekking van onderzoekers uit Texas zou eiwitten kunnen opleveren om miljoenen mensen te voeden  Momentum van een object hangt af van wat en wat?
Momentum van een object hangt af van wat en wat?  Uiterlijk kan bedrieglijk zijn:weergave versus oppervlaktekleuren
Uiterlijk kan bedrieglijk zijn:weergave versus oppervlaktekleuren Wat is Moeder Natuur, a.k.a. Aarde en vadertijd?
Wat is Moeder Natuur, a.k.a. Aarde en vadertijd?  Wat maken wetenschappers op basis van hun observaties?
Wat maken wetenschappers op basis van hun observaties?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

