
Wetenschap
Waarom is Benzeen onverzadigde redenen?
* Aanwezigheid van een PI -systeem: Benzeen heeft een ring van zes koolstofatomen, elk met een enkele binding aan twee aangrenzende koolstofatomen en een dubbele binding aan de andere. Dit vormt een continu, gedelokaliseerd PI -systeem boven en onder het vlak van de ring. Het PI -systeem wordt gevormd door de overlapping van de niet -gehybridiseerde P -orbitalen van elk koolstofatoom. Dit systeem draagt bij aan de aromaticiteit van benzeen.
* Gebrek aan extra waterstofatomen: Volgens de algemene formule voor alkanen (C n H 2n+2 ), een zes-koolstofketen zou hexaan zijn (c 6 H 14 ). Benzeen heeft echter slechts zes waterstofatomen (C 6 H 6 ). Dit komt omdat de dubbele bindingen in de ringstructuur gebruik maken van de elektronen die anders betrokken zouden zijn bij het vormen van enkele bindingen aan waterstofatomen.
* ondergaat extra reacties: Hoewel benzeen over het algemeen niet reactief is vanwege de stabiliteit, kan het aanvullende reacties onder specifieke omstandigheden ondergaan. Dit komt omdat het PI-systeem kan worden gebroken om een zeskoppige ring te vormen met enkele bindingen en zes extra waterstofatomen.
* Regel van Hückel: Benzeen volgt de regel van Hückel, waarin staat dat een vlakke, cyclische molecuul met een continue ring van p -orbitalen aromatisch is als het (4N + 2) PI -elektronen heeft. Benzeen heeft zes PI -elektronen (4 (1) + 2 =6), wat de aromatische aard ervan bevestigt.
Samenvattend wordt benzeen als onverzadigd beschouwd vanwege de unieke structuur, de aanwezigheid van een gedelokaliseerd PI -systeem en het potentieel om extra reacties te ondergaan. Deze kenmerken onderscheiden het van verzadigde koolwaterstoffen, die slechts enkele bindingen hebben en stabieler zijn.
 We kunnen het klimaat niet stabiliseren zonder CO2-compensaties - dus hoe zorgen we ervoor dat ze werken?
We kunnen het klimaat niet stabiliseren zonder CO2-compensaties - dus hoe zorgen we ervoor dat ze werken? Voorspelling voorspelt ondergemiddelde orkaanactiviteit
Voorspelling voorspelt ondergemiddelde orkaanactiviteit GPM-gegevens die worden gebruikt om de overstromende regenval van Hawaï te evalueren
GPM-gegevens die worden gebruikt om de overstromende regenval van Hawaï te evalueren Studie laat zien hoe een klein zeedier zichzelf en de oceaan voedt
Studie laat zien hoe een klein zeedier zichzelf en de oceaan voedt Wat is een generalisatie over biodiversiteit en vervuiling?
Wat is een generalisatie over biodiversiteit en vervuiling?
Hoofdlijnen
- Wat is verantwoordelijk voor het verval van organismen?
- Het menselijk lichaam bestaat meestal uit wat?
- Hoe zijn de hersenen van primaten zo groot geworden?
- Chemici ontdekken een sleuteleiwit in de manier waarop lysosomen werken
- Wat hebben alle producenten in hun cel waardoor ze fotosynthetiseren?
- Een opkomend tij van zeeziekten? Hoe parasieten reageren op een opwarmende wereld
- Welke organel vereist ATP?
- Hoe breken Linnaeus organismen in groepen-de groepen waren gebaseerd op wat?
- Hoe steroïde hormonen planten laten groeien
- Het verbinden van hoorhulpmoleculen met het oorbeen
- Onderzoekers ontdekken drukgeïnduceerd polyamorfisme in dicht zwaveldioxide

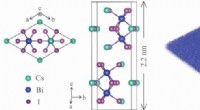
- De kansen zijn goed voor een unieke 2D-compound
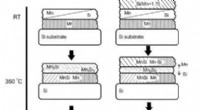
- Natuurkundigen houden toezicht op de vorming van hogere mangaansilicidefilms
- Wetenschappers suggereren een milieuvriendelijke manier om zeer actieve katalysatoren te verkrijgen

 Welke sterren bevinden zich in de kleine dipper?
Welke sterren bevinden zich in de kleine dipper?  Hoe creëren de hersenen een ononderbroken kijk op de wereld?
Hoe creëren de hersenen een ononderbroken kijk op de wereld?  Wat is een belangrijk kenmerk van indexfossiel?
Wat is een belangrijk kenmerk van indexfossiel?  Hebben vissen last van zuurstofgebrek?
Hebben vissen last van zuurstofgebrek?  Wat hebben de grotere planeten gemeen?
Wat hebben de grotere planeten gemeen?  Hoe te kijken naar verleden weer geschiedenis op data
Hoe te kijken naar verleden weer geschiedenis op data  Heb je een zoetekauw? Geef je lever de schuld
Heb je een zoetekauw? Geef je lever de schuld  Regen of sneeuw? Vochtigheid en locatie kunnen het verschil maken, blijkt uit nieuwe kaart
Regen of sneeuw? Vochtigheid en locatie kunnen het verschil maken, blijkt uit nieuwe kaart
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

