
Wetenschap
Waarom fluor en chloor vergelijkbare reactiviteiten hebben?
* Hoge elektronegativiteit: Zowel fluor als chloor hebben een sterke neiging om elektronen aan te trekken. Dit maakt ze zeer reactief en proberen een elektron te krijgen om een stabiele octetconfiguratie te bereiken.
* Kleine atoommaat: Hoewel chloor iets groter is dan fluor, hebben ze allebei relatief kleine atoomstralen. Hierdoor kunnen hun buitenste elektronen gemakkelijk toegankelijk zijn en deelnemen aan binding.
* Sterk oxiderende kracht: Beide elementen accepteren gemakkelijk elektronen, waardoor ze sterke oxiderende middelen zijn. Dit betekent dat ze gemakkelijk kunnen reageren met andere elementen, wat oxidatie veroorzaakt.
Er zijn echter ook enkele verschillen in reactiviteit:
* Fluor is het meest reactieve element: Fluor's hogere elektronegativiteit en kleinere atoomradius maken het nog reactiever dan chloor. Het vormt gemakkelijk banden met bijna alle elementen, inclusief edelgassen.
* chloor is minder reactief dan fluor: Hoewel nog steeds zeer reactief, wordt de reactiviteit van chloor getemperd door zijn iets grotere grootte en lagere elektronegativiteit.
Samenvattend:
Hoewel zowel fluor als chloor vergelijkbare reactiviteit vertonen vanwege hun halogeen aard en gedeelde eigenschappen, wordt fluor over het algemeen beschouwd als het meest reactieve element vanwege de hogere elektronegativiteit en kleinere grootte.
 Hoe duurde het nu om een atoombom te bouwen voor de Tweede Wereldoorlog?
Hoe duurde het nu om een atoombom te bouwen voor de Tweede Wereldoorlog?  Zijn exotherme reacties ontleding of zijn ze synthesereacties?
Zijn exotherme reacties ontleding of zijn ze synthesereacties?  Welke factoren hielpen atomair onderzoek vooruit?
Welke factoren hielpen atomair onderzoek vooruit?  Welke binding is eigenlijk meer een aantrekking en vindt plaats tussen watermoleculen?
Welke binding is eigenlijk meer een aantrekking en vindt plaats tussen watermoleculen?  Door wolfraam vervangen vanadiumoxide ademt frisse lucht in de katalysatortechnologie
Door wolfraam vervangen vanadiumoxide ademt frisse lucht in de katalysatortechnologie
 Meer dan 1000 ton plastic regent jaarlijks in beschermde gebieden in het westen van de VS
Meer dan 1000 ton plastic regent jaarlijks in beschermde gebieden in het westen van de VS Alternatieven voor verbranding kunnen de winst van Indiase boeren verhogen en de vervuiling verminderen
Alternatieven voor verbranding kunnen de winst van Indiase boeren verhogen en de vervuiling verminderen IJs in beweging:satellieten zien tientallen jaren van verandering
IJs in beweging:satellieten zien tientallen jaren van verandering Anderhalve eeuw aan gereconstrueerde opwarming van de oceaan biedt aanwijzingen voor de toekomst
Anderhalve eeuw aan gereconstrueerde opwarming van de oceaan biedt aanwijzingen voor de toekomst Ophoping van organische stof in zuurstofrijke meren
Ophoping van organische stof in zuurstofrijke meren
Hoofdlijnen
- Ontdekking van structurele specialisatie in talloze eierstokken
- Welke cellen zijn verantwoordelijk voor celdeling en groei in planten?
- Beschrijf en onderscheid tussen gerepliceerde chromosomen homologe chromosomen?
- Wat zijn de bouwstenen van RNA?
- Wat is levenswetenschappen?
- Wat is een natuurlijke organisatie?
- Team brengt in kaart hoe autofagie functioneert bij zoogdieren; SARS-CoV-2-infectie kan het proces verstoren
- Mysterieuze nieuwe zeebodemsoorten werpen licht op vroege evolutie van dieren
- Welke technologie was nodig voordat de celtheorie zich ontwikkelde?
- Bindingsmechanisme met eenmaal korting kan de sleutel zijn om virussen te targeten
- Verbeterde osteogene activiteit van pre-osteoblasten op aan het oppervlak gemodificeerde 3D-geprinte steigers

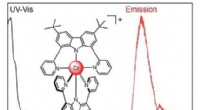
- Een nieuw chroomcomplex zendt licht uit in de ongrijpbare NIR-II-golflengte
- Nieuwe methode voor nauwkeurigere bepaling van het tijdstip van overlijden op plaats delict

- Een speciale elementaire magie

 Warmtoverdracht door geleiding treedt op wanneer moleculen?
Warmtoverdracht door geleiding treedt op wanneer moleculen?  ARS Cotton Advance helpt bij het lanceren van wondverband
ARS Cotton Advance helpt bij het lanceren van wondverband Super-opgeloste beeldvorming met één emitter van verbetering van de stralingsvervalsnelheid in nanoantennes met diëlektrische spleet
Super-opgeloste beeldvorming met één emitter van verbetering van de stralingsvervalsnelheid in nanoantennes met diëlektrische spleet  Een verloren generatie jonge wetenschappers? Afgestudeerde UM-student maakt zich zorgen over het tekort aan onderzoeksfinanciering
Een verloren generatie jonge wetenschappers? Afgestudeerde UM-student maakt zich zorgen over het tekort aan onderzoeksfinanciering  Wat is de opgeloste stof en het oplosmiddel van Buko -drankje?
Wat is de opgeloste stof en het oplosmiddel van Buko -drankje?  Impact van waterkracht uit de Amazone wordt aanzienlijk onderschat
Impact van waterkracht uit de Amazone wordt aanzienlijk onderschat Aanpassing van bestaande nitrillatex met magnetiet nanodeeltje
Aanpassing van bestaande nitrillatex met magnetiet nanodeeltje In één type Solae -energiesystemen verwarmt de lucht lucht in zonnepanelenwhich koperen buizen vullen met water wat is dit?
In één type Solae -energiesystemen verwarmt de lucht lucht in zonnepanelenwhich koperen buizen vullen met water wat is dit?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

