
Wetenschap
Hoeveel gram massief bariumsulfaat vormen wanneer 22,6 ml 0,160 M chloride reageert met 54,6 0,055 natriumsulfaat?
1. Schrijf de gebalanceerde chemische vergelijking:
Bacl₂ (aq) + na₂so₄ (aq) → baso₄ (s) + 2nacl (aq)
2. Bereken de mol van elke reactant:
* mol Bacl₂:
(22,6 ml) * (1 l / 1000 ml) * (0,160 mol / l) =0,00362 mol Bacl₂
* mol na₂so₄:
(54,6 ml) * (1 l / 1000 ml) * (0,055 mol / l) =0,00300 mol NA₂SO₄
3. Bepaal de beperkende reactant:
* De gebalanceerde vergelijking toont een 1:1 molverhouding tussen BACL₂ en Na₂so₄.
* Omdat we minder mol na₂so₄ (0,00300 mol) hebben dan BACL₂ (0,00362 mol), is Na₂so₄ de beperkende reactant. Dit betekent dat het volledig zal worden geconsumeerd en de hoeveelheid gevormde baso₄ wordt bepaald door de hoeveelheid na₂so₄.
4. Bereken de mol Baso₄ gevormd:
* De 1:1 molverhouding uit de gebalanceerde vergelijking vertelt ons dat 0,00300 mol Na₂so₄ 0,00300 mol baso₄ zal produceren.
5. Converteer mol Baso₄ om te grammen:
* Molaire massa van baso₄ =137,33 g/mol + 32,06 g/mol + (4 * 16.00 g/mol) =233,39 g/mol
* Massa van Baso₄ =(0,00300 mol) * (233,39 g/mol) = 0.700 g
Daarom zal 0,700 gram vast bariumsulfaat ontstaan.
 Zorgt een verminderde dampdruk op grote hoogte ervoor dat een vloeistof bij hogere temperaturen gaat koken?
Zorgt een verminderde dampdruk op grote hoogte ervoor dat een vloeistof bij hogere temperaturen gaat koken?  Wat is het woord vergelijking voor reactie van chloor met water?
Wat is het woord vergelijking voor reactie van chloor met water?  Welk effectdosemperatuur heeft de reactiesnelheid?
Welk effectdosemperatuur heeft de reactiesnelheid?  Met welke eigenschap van isotopen kan radiotracers nuttig zijn bij het bestuderen van chemische reacties?
Met welke eigenschap van isotopen kan radiotracers nuttig zijn bij het bestuderen van chemische reacties?  Is suiker een reactant of product?
Is suiker een reactant of product?
 We kunnen in de nabije toekomst meer emissies van olieraffinaderijen verwachten, analyse vondsten
We kunnen in de nabije toekomst meer emissies van olieraffinaderijen verwachten, analyse vondsten Hoe verhoudt elke bodemlaag zich tot de horizon?
Hoe verhoudt elke bodemlaag zich tot de horizon?  Wat is het bos ten zuiden van Tundra?
Wat is het bos ten zuiden van Tundra?  Inslagen van oude asteroïden speelden een rol bij het ontstaan van de continenten van de aarde
Inslagen van oude asteroïden speelden een rol bij het ontstaan van de continenten van de aarde Dubbel probleem:overstromingen en COVID-19 zijn samengesmolten en vormen een groot gevaar voor Oost-Timor
Dubbel probleem:overstromingen en COVID-19 zijn samengesmolten en vormen een groot gevaar voor Oost-Timor
Hoofdlijnen
- Het belang van wetenschappelijke namen voor organismen
- Wat kunnen zeepijpen ons vertellen over neurodegeneratie?
- Wat is de rol van DNA in cel?
- Wat is definitief in de wetenschap?
- Nieuw inzicht in waarom de ziekte van Pierce zo dodelijk is voor wijnstokken
- Hoe werden organismen gegroepeerd vóór Linnaeus?
- Wat is de juiste volgorde van de structuur van de organisme?
- Nieuwe onderzoeken laten zien hoe je parasieten kunt redden en waarom dit belangrijk is
- Welke speciale dingen moeten alle cellen doen?
- Nieuwe methode maakt geautomatiseerd snel onderzoek van enzymatische processen mogelijk
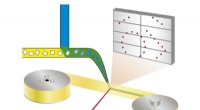
- Een eeuwenoud model voor het ontstaan van levens krijgt flinke onderbouwing
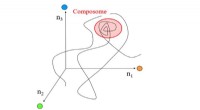
- Onderzoekers creëren eerste koolstofvezels met uniforme poreuze structuur
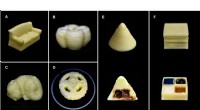
- Onderzoekers ontwikkelen eenvoudige methode om melkproducten in 3D te printen
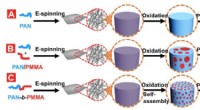
- Nieuwe strategie om katalysatoren met één atoom te fabriceren via elektrochemische depositie

 Beschrijf drie horizonten van een resterende grond?
Beschrijf drie horizonten van een resterende grond?  Moet de maan tijdens een zonsverduistering dichter op aarde of zon zijn?
Moet de maan tijdens een zonsverduistering dichter op aarde of zon zijn?  Welke twee energiebronnen voor processen in lithosfeer Hydrosfeer atmosfeer biosfeer?
Welke twee energiebronnen voor processen in lithosfeer Hydrosfeer atmosfeer biosfeer?  Vorm een hypothese over de massa en het volume van een mol spliterwten?
Vorm een hypothese over de massa en het volume van een mol spliterwten?  Nieuw inzicht in hoe magma vulkaanuitbarstingen voedt
Nieuw inzicht in hoe magma vulkaanuitbarstingen voedt Parijs remt af op deelregeling elektrische auto's
Parijs remt af op deelregeling elektrische auto's Hoe wordt een elektroscoop opgeladen door wrijving?
Hoe wordt een elektroscoop opgeladen door wrijving?  Eén gewoonte tegelijk bouwen aan een duurzame levensstijl
Eén gewoonte tegelijk bouwen aan een duurzame levensstijl
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

