
Wetenschap
Wat is de orbitale notatie van zwavel?
Sulphur's elektronische configuratie:
* Atomisch nummer: 16 (wat betekent dat het 16 protonen en 16 elektronen heeft)
* Elektronische configuratie: 1S² 2S² 2P⁶ 3S² 3P⁴
orbitale notatie:
* 1S: ↑ ↓ (2 elektronen)
* 2S: ↑ ↓ (2 elektronen)
* 2p: ↑ ↓ ↑ ↓ ↑ (6 elektronen)
* 3S: ↑ ↓ (2 elektronen)
* 3P: ↑ ↓ ↑ (4 elektronen)
Verklaring:
* orbitalen: Elektronen bezetten specifieke ruimte van ruimte rond de kern die orbitalen worden genoemd. We gebruiken het principe -kwantumnummer (N) om het energieniveau (1, 2, 3, enz.) En letters (s, p, d, f) aan te geven om de orbitale vormen weer te geven.
* s orbitalen: Elke s orbitale kan maximaal 2 elektronen bevatten.
* P orbitalen: Elke P -subshell heeft drie orbitalen (PX, PY, PZ), elk in staat om 2 elektronen vast te houden.
* Hund's Rule: Elektronen vullen elk orbitaal individueel in een subshell voordat u het koppelt.
* Pauli -uitsluitingsprincipe: Elk orbitaal kan maximaal 2 elektronen bevatten en ze moeten tegengestelde spins hebben (weergegeven door pijlen die op en neer wijzen).
Sleutelpunten:
* Zwavel heeft 6 valentie -elektronen (elektronen in de buitenste schaal).
* Deze valentie -elektronen bepalen het chemische gedrag van zwavel.
* De orbitale notatie helpt visualiseren hoe de elektronen in het atoom worden verdeeld.
Laat het me weten als je nog vragen hebt!
 Klimaatverandering brengt een nieuwe wereld van Australische bosbranden met zich mee
Klimaatverandering brengt een nieuwe wereld van Australische bosbranden met zich mee Hoe planten hun fotosynthese aanpassen aan veranderend licht
Hoe planten hun fotosynthese aanpassen aan veranderend licht  EPA moet gelijke tred houden met de wetenschap, meer doen om kwetsbare bevolkingsgroepen te beschermen
EPA moet gelijke tred houden met de wetenschap, meer doen om kwetsbare bevolkingsgroepen te beschermen Klimaatverandering vormt een levenslang gezondheidsrisico voor kinderen
Klimaatverandering vormt een levenslang gezondheidsrisico voor kinderen Amazone regenwoudbranden:alles wat je moet weten
Amazone regenwoudbranden:alles wat je moet weten
Hoofdlijnen
- Fish and chips op Mars:Onderzoek toont aan hoe kolonisten hun eigen voedsel konden produceren
- Eetbaar diercelproject met Candy
- Je bent wat je eet – als je een koraalrifvis bent
- Celdeling in eukaryoten verschilt van celprokaryoten omdat?
- Met welke geërfde eigenschappen worden mensen geboren?
- Heeft Ecoli een prokaryotische cel?
- Wat is het belang van DNA in transmissie -eigenschap?
- De functie van modellen in de wetenschap?
- Wat zijn enkele lichaamsdelen die beginnen met de letter P E C A?
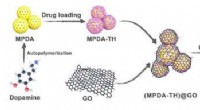
- Op cellulose-nanofibril gebaseerde inkapselingsstructuur om de afgifte van geneesmiddelen te regelen
- Een nieuwe methode om waterstof efficiënter uit water te halen om duurzame energie op te vangen
- Nieuwe techniek kan medicijnontwerp stroomlijnen

- Ongebruikelijk halfmetaal vertoont bewijs van unieke toestanden van oppervlaktegeleiding

- Door meniscus ondersteunde techniek produceert perovskiet PV-films met een hoog rendement

 Welk type energie wordt opgeslagen en hangt af van de interactieobjecten deeltjes of atomen?
Welk type energie wordt opgeslagen en hangt af van de interactieobjecten deeltjes of atomen?  Alleen bij de evenaar zijn alle sterren zichtbaar in het loop van het jaar?
Alleen bij de evenaar zijn alle sterren zichtbaar in het loop van het jaar?  Welk deel van de uienplant dient als opslagorgel?
Welk deel van de uienplant dient als opslagorgel?  Wetenschappers transformeren de manier waarop complexe mariene gegevens van de Ocean Health Index worden gesynthetiseerd en gecommuniceerd
Wetenschappers transformeren de manier waarop complexe mariene gegevens van de Ocean Health Index worden gesynthetiseerd en gecommuniceerd  Wat is een negatieve vector in de natuurkunde?
Wat is een negatieve vector in de natuurkunde?  Wat is een biologisch middel dat niet vanzelf kan reproduceren?
Wat is een biologisch middel dat niet vanzelf kan reproduceren?  Zout water kruipt richting New Orleans langs de Mississippi-rivier
Zout water kruipt richting New Orleans langs de Mississippi-rivier Ongebreideld gebruik van antibacterieel nanozilver is een risico op resistentie
Ongebreideld gebruik van antibacterieel nanozilver is een risico op resistentie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

