
Wetenschap
Trekt chloor van release -elektron aan en zo ja, hoeveel zijn er betrokken?
* elektronegativiteit: Chloor is zeer elektronegatief, wat betekent dat het een sterke neiging heeft om elektronen naar zichzelf aan te trekken. Dit komt door zijn positie op het periodieke tabel.
* Elektronenconfiguratie: Chloor heeft 7 elektronen in zijn buitenste schaal en wil een stabiele octet (8 elektronen) configuratie bereiken. Door één elektron te krijgen, kan het deze stabiele toestand bereiken.
Hoeveel elektronen?
Chloor typisch wint één elektron om een chloride-ion te vormen (Cl-). Dit komt omdat het verkrijgen van één elektron zijn buitenste schaal voltooit en het stabieler maakt.
Voorbeeld: Wanneer chloor reageert met natrium (NA), verliest natrium één elektron om Na+ en chloorwinst te worden dat elektron om Cl- te worden. Dit vormt het ionische samengestelde natriumchloride (NaCl).
 Bij alfaverval kunnen het ouderelement en de dochter verschillende isotopen van hetzelfde zijn, maar bij bèta zijn ze altijd hetzelfde?
Bij alfaverval kunnen het ouderelement en de dochter verschillende isotopen van hetzelfde zijn, maar bij bèta zijn ze altijd hetzelfde?  Hoeveel atomen heeft Pottasium -chloride?
Hoeveel atomen heeft Pottasium -chloride?  Wat zijn de atomen in één molecuul kaliumhydroxide?
Wat zijn de atomen in één molecuul kaliumhydroxide?  Zijn zuren van plantenwortels die rotsen een mechanische reactie verbreken?
Zijn zuren van plantenwortels die rotsen een mechanische reactie verbreken?  Wat illustreert het bestaan van Cu2oand Cuo?
Wat illustreert het bestaan van Cu2oand Cuo?
 Overstromingen hoofdstad Indonesië laten 43 doden 397, 000 ontheemd
Overstromingen hoofdstad Indonesië laten 43 doden 397, 000 ontheemd Gewasbesparende bodemtesten nu binnen handbereik van boeren
Gewasbesparende bodemtesten nu binnen handbereik van boeren Uit onderzoek blijkt hoe het zoutgehalte de diversiteit van El Niño beïnvloedt
Uit onderzoek blijkt hoe het zoutgehalte de diversiteit van El Niño beïnvloedt  Onderzoekers onderzoeken hoe overstromingen en droogtes de wetenschappelijke samenleving wereldwijd uitdagen
Onderzoekers onderzoeken hoe overstromingen en droogtes de wetenschappelijke samenleving wereldwijd uitdagen  Beperking van de opwarming tot 2 C vereist een emissiereductie van 80% boven de doelstellingen van de Overeenkomst van Parijs
Beperking van de opwarming tot 2 C vereist een emissiereductie van 80% boven de doelstellingen van de Overeenkomst van Parijs
Hoofdlijnen
- Freeze frame:Onderzoekers lossen op hoe cellen eiwitten ontvouwen
- Wat is de rol van zweetbij voor lijkbloem?
- Wat is de term voor een plant die zaad produceert zonder beschermende dekking?
- Waar in de cel bevinden zich enzymen?
- Wat zijn de belangrijkste functies van eenvoudige koolhydraten in levende wezens?
- Welke kenmerken moet een levend ding worden geclassificeerd als een amfibie?
- Wat is een groep gerelateerde soorten hetzelfde?
- Waarom DNA de meest gunstige molecule is voor genetisch materiaal en hoe RNA zich hiermee verhoudt
- Als de sequentie van nucleotiden op één streng een DNA -molecuul is, is GCCATTG -complementry dat?
- De toekomst van elektronica is rekbaar
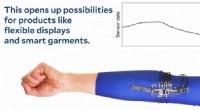
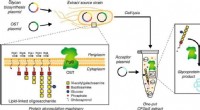
- Bio-ingenieurs creëren een weg naar gepersonaliseerde geneeskunde
- Maakt het mogelijk om grotere 3D-geprinte objecten te maken met keramiek

- Superdiamond koolstof-borium kooien kunnen verschillende eigenschappen opvangen en aanboren

- NIST geeft eerste standaardreferentiemateriaal uit voor kwantitatieve analyse van glycanen
 Hoe beïnvloeden de mensen de aarde?
Hoe beïnvloeden de mensen de aarde?  Hoe werken zonnepanelen?
Hoe werken zonnepanelen?  Hoe beïnvloedt het magnetische veld van de aarde een kompas?
Hoe beïnvloedt het magnetische veld van de aarde een kompas?  Wat is geothermisch?
Wat is geothermisch?  Smelt Ice Ice sneller in water of frisdrank?
Smelt Ice Ice sneller in water of frisdrank?  Hoe een model te maken Plant & Dierlijke cel
Hoe een model te maken Plant & Dierlijke cel Studie:Ondanks training, De politiediensten van Vermont vertonen nog steeds wijdverbreide raciale vooroordelen
Studie:Ondanks training, De politiediensten van Vermont vertonen nog steeds wijdverbreide raciale vooroordelen Hoeveel elektriciteit verspilt een automaat?
Hoeveel elektriciteit verspilt een automaat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

