
Wetenschap
Het kookpunt van waterstofsulfide iets hoger dan selenide?
Dit is waarom:
* intermoleculaire krachten: De primaire krachten die moleculen in de vloeibare toestand houden, zijn van der Waals -krachten. Deze krachten nemen toe met de grootte en polariseerbaarheid van het molecuul.
* Grootte en polariseerbaarheid: Selenium is groter en meer polariseerbaar dan zwavel. Dit betekent dat de elektronenwolk in een waterstofselenide -molecuul gemakkelijker te vervormen is, wat leidt tot sterkere tijdelijke dipolen (London Dispersion Forces).
* waterstofbinding: Hoewel niet zo sterk als in water, vertoont waterstofsulfide zwakke waterstofbinding, wat bijdraagt aan een iets hoger kookpunt in vergelijking met waterstofselenide.
Echter:
Hoewel H₂s een hoger kookpunt heeft dan H₂se, is het nog steeds een relatief laag kookpuntverbinding vanwege de zwakke intermoleculaire krachten.
Hier zijn de geschatte kookpunten:
* waterstofsulfide (H₂s): -60 ° C (-76 ° F)
* waterstof selenide (h₂se): -41 ° C (-42 ° F)
 Waterstof en chloorcombinatie om zoutzuur te produceren zoals getoond in de vergelijking onder H2 C12 - 2HC1 Is deze reactie exotherme of endotherm?
Waterstof en chloorcombinatie om zoutzuur te produceren zoals getoond in de vergelijking onder H2 C12 - 2HC1 Is deze reactie exotherme of endotherm?  Wat is een voorbeeld van koolstofdioxide?
Wat is een voorbeeld van koolstofdioxide?  Waarom samentrekken vaste stoffen vloeistoffen en gassen als ze worden gekoeld?
Waarom samentrekken vaste stoffen vloeistoffen en gassen als ze worden gekoeld?  Neutralisatie van pathogene schimmels met immunotherapeutica met kleine moleculen
Neutralisatie van pathogene schimmels met immunotherapeutica met kleine moleculen Geef de juiste naam voor deze Type1 binaire verbindingen KCL?
Geef de juiste naam voor deze Type1 binaire verbindingen KCL?
 Hoe verzwakte Amerikaanse regelgeving voor fossiele brandstoffen de milieurechtvaardigheid in Colorado bedreigt?
Hoe verzwakte Amerikaanse regelgeving voor fossiele brandstoffen de milieurechtvaardigheid in Colorado bedreigt? Antibiotica op stortplaatsen vormen een risico voor de volksgezondheid
Antibiotica op stortplaatsen vormen een risico voor de volksgezondheid Een reeks gelukkige gebeurtenissen - Antarctische zirkonen vertellen het verhaal van vroeg vulkanisme
Een reeks gelukkige gebeurtenissen - Antarctische zirkonen vertellen het verhaal van vroeg vulkanisme Het oude regenregime van de Groene Sahara onthuld
Het oude regenregime van de Groene Sahara onthuld Cohousing is een inclusieve benadering van slimme, duurzame steden
Cohousing is een inclusieve benadering van slimme, duurzame steden
Hoofdlijnen
- Wetenschappers bepalen hoe voorlopers van genregulerende kleine RNA's worden gesorteerd door cellulaire machines
- Waarom worden ze omega-3-vetzuren genoemd?
- Vraag en antwoord:Onderzoek naar de opmerkelijke voortplantingscyclus van de bedreigde weekdieren in Michigan
- Bacteriën zijn de eenvoudigste enkele cellen die?
- Wat zijn ecosystemen met veel verbonden voedselketens?
- Met welk systeem werkt het gespierde op de voet?
- In welk proces kan één celled organismen produceren?
- Hebben leden van een soort niet het vermogen om nieuwe individuen te produceren?
- Wat is de betekenis van endosporen?
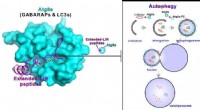
- Wetenschappers ontdekken autofagieremmende peptiden van gigantische ankyrinen
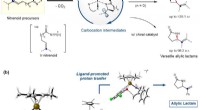
- Nieuwe katalytische benadering voor toegang tot belangrijke intermediaire carbokation
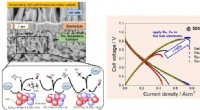
- Onderzoekers ontwikkelen hoogwaardige keramische brandstofcel die werkt op butaangas
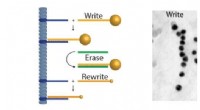
- DNA als supramoleculaire bouwsteen
- Samenwerking levert ontdekking van 12-zijdige silica kooien op

 Wat is een wateraardbeving?
Wat is een wateraardbeving?  Hoe kan een organisme in het vierde tropische niveau energie verkrijgen van de zon?
Hoe kan een organisme in het vierde tropische niveau energie verkrijgen van de zon?  Nieuw onderzoek toont aan dat hoge en oudere Amazonebossen beter bestand zijn tegen droogte
Nieuw onderzoek toont aan dat hoge en oudere Amazonebossen beter bestand zijn tegen droogte Strijd tussen Trump en staten over autovervuiling leidt tot rechtbank
Strijd tussen Trump en staten over autovervuiling leidt tot rechtbank Gedeeltelijke druk opzoeken
Gedeeltelijke druk opzoeken  Zijn planten die Cross Pollinate Called Offspring?
Zijn planten die Cross Pollinate Called Offspring?  Waarom mensen op politici stemmen waarvan ze weten dat het leugenaars zijn
Waarom mensen op politici stemmen waarvan ze weten dat het leugenaars zijn  Waarom explodeert natriumchloride in water?
Waarom explodeert natriumchloride in water?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

