
Wetenschap
Waarom is NaCl erg oplosbaar, maar niet slechts een beetje in water?
NaCl (natriumchloride)
* ionische binding: NaCl is een ionische verbinding, wat betekent dat deze wordt gevormd door de elektrostatische aantrekkingskracht tussen positief geladen natriumionen (Na+) en negatief geladen chloride-ionen (Cl-).
* Sterke hydratatie: Wanneer NaCl oplost in water, omringen de polaire watermoleculen de ionen. Het positieve uiteinde van het watermolecuul (waterstof) wordt aangetrokken door de negatief geladen chloride -ionen en het negatieve uiteinde van het watermolecuul (zuurstof) wordt aangetrokken door de positief geladen natriumionen. Dit proces, hydratatie genoemd, trekt de ionen effectief uit elkaar en houdt ze gescheiden in oplossing.
* Hoge oplosbaarheid: De sterke hydratatie van de ionen, gecombineerd met de relatief zwakke ionische bindingen in NaCl, leidt tot hoge oplosbaarheid.
Cao (calciumoxide)
* ionische binding: Cao is ook een ionische verbinding, met calciumionen (Ca2+) en oxide-ionen (O2-). De binding tussen calcium en zuurstof is echter sterker dan de binding in NaCl.
* Beperkte hydratatie: Watermoleculen kunnen de calciumionen hydrateren, maar de oxide -ionen zijn zeer reactief. Wanneer CAO reageert met water, ondergaat het een krachtige exotherme reactie, waarbij calciumhydroxide (Ca (OH) 2) wordt gevormd, ook bekend als geslepen limoen. Deze reactie is veel belangrijker dan het hydratatieproces dat optreedt bij NaCl.
* Lage oplosbaarheid: De sterke ionische bindingen in Cao en de snelle reactie met water om calciumhydroxide te vormen, maken het slechts licht oplosbaar in water.
Samenvattend:
* NaCl is zeer oplosbaar omdat de ionische bindingen relatief zwak zijn en watermoleculen de ionen effectief hydrateren.
* Cao is slechts enigszins oplosbaar vanwege zijn sterke ionische bindingen en de snelle reactie met water om calciumhydroxide te vormen, die minder oplosbaar is dan Cao zelf.
 Is ontbijtgranen een compound in de wetenschap?
Is ontbijtgranen een compound in de wetenschap?  Hoe maak je onderscheid tussen hexaan en ethanol?
Hoe maak je onderscheid tussen hexaan en ethanol?  Welke kleur is natriumhydroxide wanneer u Universal Indicator toevoegt?
Welke kleur is natriumhydroxide wanneer u Universal Indicator toevoegt?  Waarom is siliciumdioxide een vaste stof?
Waarom is siliciumdioxide een vaste stof?  Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld
Met een keukenvriezer en plantaardige cellulose, een aerogel voor therapeutisch gebruik is ontwikkeld
 Mobiele technologie gebruiken om het impactpotentieel van landbouwinterventies te begrijpen
Mobiele technologie gebruiken om het impactpotentieel van landbouwinterventies te begrijpen Klimaatverandering:wat als ziekten zich naar het zuiden verplaatsen in plaats van naar het noorden?
Klimaatverandering:wat als ziekten zich naar het zuiden verplaatsen in plaats van naar het noorden?  Koolstofputten in oude bossen overschat
Koolstofputten in oude bossen overschat Onderzoekers laten zien hoe organische koolstofverbindingen die door bomen worden uitgestoten de luchtkwaliteit beïnvloeden
Onderzoekers laten zien hoe organische koolstofverbindingen die door bomen worden uitgestoten de luchtkwaliteit beïnvloeden  Meer flexibiliteit voor telers nodig tijdens droogte
Meer flexibiliteit voor telers nodig tijdens droogte
Hoofdlijnen
- Welk type chemische boodschapper stimuleert de cel die deze oorspronkelijk heeft uitgescheiden?
- Wat maken wetenschappers om hen te helpen een hypothese of gegevens te verzamelen tijdens een experiment?
- Paddestoelen vormen de hoofdpersoon in de meeste ecosystemen
- Waar is ATPase -enzym nodig voor spiercontractie?
- Hoe cellen beslissen op welke manier ze hun inhoud willen recyclen
- Wat is een wetenschappelijk symbool?
- Wat zijn organismen die energie verkrijgen door zich te voeden met andere organismen?
- Hoe bijen leven met bacteriën
- De wilde ezel keert terug
- Een nieuw hulpmiddel voor cryo-elektronenmicroscopie

- Nieuw pad naar vorming van zeldzame aardmineralen heeft gevolgen voor groene energie en slimme technologie

- Nieuwe modelleringsaanpak helpt bij het ontwerpen van laserglas

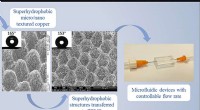
- Nieuw productieproces creëert superkleine kanalen om water af te weren en medische, elektronische apparaten
- Bewijsstuk A en andere echte misdaadshows kunnen misvattingen over forensische wetenschap aanwakkeren

 Actieve laag in verschillende vries-dooistadia wijzigt de dynamiek van de bodemademhaling
Actieve laag in verschillende vries-dooistadia wijzigt de dynamiek van de bodemademhaling Hoe Euclidische afstand berekenen
Hoe Euclidische afstand berekenen  Aan het einde van de supermarkt kunnen zwermrobots je bestelling opnemen
Aan het einde van de supermarkt kunnen zwermrobots je bestelling opnemen Stenen die tegen elkaar worden gedrukt, wat is dat?
Stenen die tegen elkaar worden gedrukt, wat is dat?  Enquête toont aan dat nieuwe levensstijlvoorkeuren een nieuw tijdperk voor de werkplek inluiden
Enquête toont aan dat nieuwe levensstijlvoorkeuren een nieuw tijdperk voor de werkplek inluiden Om netto nulemissie te bereiken, het VK moet verder gaan dan het uitschakelen van de koolstofkranen
Om netto nulemissie te bereiken, het VK moet verder gaan dan het uitschakelen van de koolstofkranen Wat is de vergelijking van uniforme rechtlijnige beweging?
Wat is de vergelijking van uniforme rechtlijnige beweging?  Opslagkamers binnen een cel heten?
Opslagkamers binnen een cel heten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

