
Wetenschap
Waarom vormen elementen van groep 1 gemakkelijk verbindingen?
* Lage ionisatie -energie: Alkali -metalen hebben een lage ionisatie -energie, wat betekent dat het relatief weinig energie vereist om hun buitenste elektron te verwijderen. Dit maakt hen gemakkelijk bereid dit elektron op te geven.
* Grote atoommaat: Alkali -metalen hebben grote atoomstralen in vergelijking met andere elementen in hun menstruatie. Dit betekent dat hun valentie -elektron verder van de kern is en een zwakkere aantrekkingskracht ervaart, waardoor het gemakkelijker te verwijderen is.
* Vorming van stabiele ionen: Door hun enkele valentie -elektron te verliezen, bereiken alkali -metalen een stabiele elektronenconfiguratie, vergelijkbaar met de edelgassen, waardoor ze zeer stabiel zijn.
Hoe dit leidt tot samengestelde vorming:
* Wanneer alkali -metalen reageren met niet -metalen, brengen ze hun valentie -elektron gemakkelijk over naar het niet -metalen atoom.
* Deze elektronenoverdracht resulteert in de vorming van een ionische binding, waarbij het positief geladen metaalion (kation) wordt aangetrokken tot het negatief geladen niet -metalen ion (anion).
* De sterke elektrostatische aantrekkingskracht tussen deze ionen leidt tot de vorming van een stabiele ionische verbinding.
Voorbeeld:
Natrium (NA) van groep 1 reageert met chloor (CL) van groep 17 om natriumchloride (NaCl) te vormen, een gemeenschappelijk tafelzout. Natrium verliest gemakkelijk zijn ene valentie-elektron aan chloor en vormt een positief geladen natriumion (Na+) en een negatief geladen chloride-ion (Cl-). Deze tegengesteld geladen ionen worden vervolgens tot elkaar aangetrokken en vormen de ionische samengestelde NaCl.
Concluderend maken de lage ionisatie -energie, grote atoomgrootte en de vorming van stabiele ionen alkali -metalen zeer reactief en vormen gemakkelijk verbindingen, met name ionische verbindingen.
 Welke laboratoriumapparatuur wordt gebruikt voor het drogen van zouten?
Welke laboratoriumapparatuur wordt gebruikt voor het drogen van zouten?  Chemische reacties die Light
Chemische reacties die Light Welk molecuul bestaat uit xenon en vier zuurstof?
Welk molecuul bestaat uit xenon en vier zuurstof?  Welke delen van het calciumchloride worden aangetrokken door welk watermolecuul?
Welke delen van het calciumchloride worden aangetrokken door welk watermolecuul?  Apparaten voor hoge temperaturen gemaakt van films die buigen als ze ademen
Apparaten voor hoge temperaturen gemaakt van films die buigen als ze ademen
 Dinosaurussen stijgen op aangedreven door vulkanen die klimaatverandering aandrijven
Dinosaurussen stijgen op aangedreven door vulkanen die klimaatverandering aandrijven Studie werpt licht op de microklimaatimpact van bosbranden
Studie werpt licht op de microklimaatimpact van bosbranden Leg uit waarom objecten die verder weg zijn er voor ons jonger uitzien dan wanneer ze dichter bij ons zouden zijn?
Leg uit waarom objecten die verder weg zijn er voor ons jonger uitzien dan wanneer ze dichter bij ons zouden zijn?  Soorten wolken voor kinderen
Soorten wolken voor kinderen  NASA's Aqua Satellite ziet overblijfselen van extra-tropische cycloon Nanmadols ten oosten van Japan
NASA's Aqua Satellite ziet overblijfselen van extra-tropische cycloon Nanmadols ten oosten van Japan
Hoofdlijnen
- Wat is de naam van de microscoop die voornamelijk in de klas wordt gebruikt?
- Hoe wordt DNA gebruikt om organismen te helpen classificeren?
- Waarom zijn haarvaten slechts één cel dik?
- Bloedbad vreest race om zeldzame Australische papegaai te redden
- Eten of seks? Fruitvliegjes geven inzicht in besluitvorming
- Welk nucleïnezuur voert zijn functie niet uit in het ribosoom?
- Langstlevende dolfijn in gevangenschap sterft in aquarium Japan
- Welke herverpakte eiwitten in een cel?
- Hoe ondersteunen studies van lichaamsstructuur en embryo's evolutie?
- Een nieuw gelerend molecuul voor het kweken van neuronen in 3-D
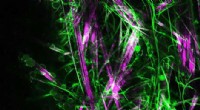
- Gladde katheter met dubbele werking bestrijdt bacteriën
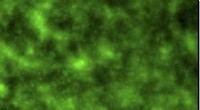
- Nieuwe technologie kan helpen water af te stoten, levens redden door verbeterde medische hulpmiddelen

- Onderzoekers observeren direct de membraanbinding van α-synucleïne in levende cellen

- Groene eiwitten maken uit de lucht

 Het afschaffen van essays zal niet noodzakelijkerwijs voorkomen dat studenten vals spelen
Het afschaffen van essays zal niet noodzakelijkerwijs voorkomen dat studenten vals spelen Composietfilm is veelbelovend als vervanging voor transparante elektrische geleiders in displays
Composietfilm is veelbelovend als vervanging voor transparante elektrische geleiders in displays Foto's van 'king tiids' laten wereldwijd de risico's van klimaatverandering zien
Foto's van 'king tiids' laten wereldwijd de risico's van klimaatverandering zien  Zijn er koolstofatomen in een augurk?
Zijn er koolstofatomen in een augurk?  Wat schadelijk van bacteriën?
Wat schadelijk van bacteriën?  Gegevenslacunes belemmeren het begrip van de ervaringen van transgenders, zeggen onderzoekers
Gegevenslacunes belemmeren het begrip van de ervaringen van transgenders, zeggen onderzoekers  Zijn wolven de beste vriend van de Gaffelbok?
Zijn wolven de beste vriend van de Gaffelbok?  Formule? - Antwoorden
Formule? - Antwoorden
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

