
Wetenschap
Wat is de enthalpie en entropie -verandering wanneer ammoniumchloride opgelost in water?
Enthalpy Change (ΔH)
* Endotherme proces: Het oplossen van ammoniumchloride in water is een endotherme proces. Dit betekent dat warmte wordt geabsorbeerd uit de omgeving, wat resulteert in een positieve enthalpie -verandering (ΔH> 0).
* Waarom endotherm?
* Het proces omvat het verbreken van de ionische bindingen in het ammoniumchloridekristalrooster, dat energie -input vereist.
* De daaropvolgende hydratatie van de ionen (ammonium en chloride) door watermoleculen geeft enige energie vrij, maar dit is niet voldoende om de energie te compenseren die nodig is om de ionische bindingen te verbreken.
Entropiewijziging (AS)
* Verhoging van entropie: Het oplossen van ammoniumchloride in water leidt tot een toename van entropie (AS> 0).
* Waarom verhoogde entropie?
* Verhoogde stoornis: De sterk geordende, kristallijne structuur van ammoniumchloride wordt verstoord wanneer deze oplost. De ionen worden gedurende de oplossing verspreid en verhogen de algehele aandoening van het systeem.
* Verhoogde hydratatie: De watermoleculen rond de ionen hebben meer bewegingsvrijheid in vergelijking met hun gestructureerde opstelling in zuiver water. Dit draagt ook bij aan een toename van entropie.
Samenvatting
* Enthalpy (ΔH): Positief (endotherm)
* entropie (δs): Positief (toename van de wanorde)
Belangrijke opmerking: De exacte waarden voor AH en A's zijn afhankelijk van de temperatuur, concentratie en andere experimentele omstandigheden.
in eenvoudiger termen:
Wanneer ammoniumchloride oplost in water, voelt het koud aan omdat het warmte van de omgeving absorbeert (endotherm). Dit komt omdat er meer energie nodig is om de kristalstructuur uit elkaar te breken dan wordt vrijgegeven wanneer de ionen omgeven worden door watermoleculen. De aandoening van het systeem neemt echter toe omdat de ionen verspreid worden en de watermoleculen mobieler worden (verhoogde entropie).
 Wat weermannen weten over klimaatverandering
Wat weermannen weten over klimaatverandering  Bespreek de aard van de wetenschap als proces en product?
Bespreek de aard van de wetenschap als proces en product?  Spuitbussen voegen een nieuwe rimpel toe aan klimaatverandering in de tropische Stille Oceaan
Spuitbussen voegen een nieuwe rimpel toe aan klimaatverandering in de tropische Stille Oceaan De aarde zal deze eeuw waarschijnlijk meer dan 2 graden opwarmen
De aarde zal deze eeuw waarschijnlijk meer dan 2 graden opwarmen De natuur heeft een enorm potentieel om klimaatverandering en biodiversiteitsverlies in het VK te bestrijden
De natuur heeft een enorm potentieel om klimaatverandering en biodiversiteitsverlies in het VK te bestrijden
Hoofdlijnen
- De bloedbaan ontvangt veel van het voedsel dat in dunne darm is opgelost, waar of onwaar?
- Welk molecuul is verantwoordelijk voor het dragen van de genetische informatie van Thenucleus naar ribosomen?
- In planten is eenvoudige suiker het minst waarschijnlijk?
- Genetische redding bevordert het herstel van de met uitsterven bedreigde Australische dwergbuidelmuizen
- Facebook-regels in één oogopslag:wat is er precies verboden?
- Wat voor soort weefsel slaat voedingsstoffen op in planten?
- Welk orgaan produceert enzymen die vetten en koolhydraten afbreken?
- Veel dingen kunnen er een creëren.
- Voorbeelden van sensorische adaptatie
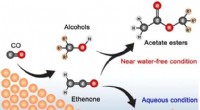
- Duurzame elektrosynthese van esters
- Kwantumfysica en origami voor de ultieme beterschapskaart

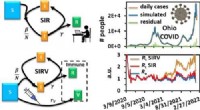
- Chemielabstudenten voorspellen verspreiding van COVID-19 met kinetische modellen
- Wetenschappers bedenken diervrije testen van dodelijke neurotoxines

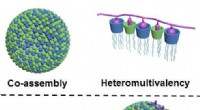
- Chemici ontwikkelen nieuwe methode voor selectieve binding van eiwitten
 Blikseminslagen speelden een cruciale rol bij het ontstaan van levens op aarde:studie
Blikseminslagen speelden een cruciale rol bij het ontstaan van levens op aarde:studie Katalysatoromschakeling betekent dat vier één worden
Katalysatoromschakeling betekent dat vier één worden Wat zijn de schadelijke effecten van zonne -energie?
Wat zijn de schadelijke effecten van zonne -energie?  Renault, Nissan, Mitsubishi bevestigt opnieuw commitment aan alliantie
Renault, Nissan, Mitsubishi bevestigt opnieuw commitment aan alliantie Een satelliet met een harpoen, net en sleepzeil om ruimteafval te vangen is in een baan om de aarde en zal binnenkort worden getest
Een satelliet met een harpoen, net en sleepzeil om ruimteafval te vangen is in een baan om de aarde en zal binnenkort worden getest Nieuw model maakt voorspellingen mogelijk over hoe nanodeeltjes ontstaan, geeft aanwijzingen over hoe het proces kan worden gecontroleerd
Nieuw model maakt voorspellingen mogelijk over hoe nanodeeltjes ontstaan, geeft aanwijzingen over hoe het proces kan worden gecontroleerd Als een persoon rent met hoeveel kracht elke voet de grond raakt?
Als een persoon rent met hoeveel kracht elke voet de grond raakt?  Waar in een kikker kunt u diploïde cellen vinden?
Waar in een kikker kunt u diploïde cellen vinden?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

