
Wetenschap
Waarom zijn alle koolstof-koolstofbindingslengtes in benzeen gelijk?
1. de structuur van Benzeen: Benzeen heeft een ring van zes koolstofatomen, elk gebonden aan één waterstofatoom. De standaardweergave van benzeen toont afwisselende enkele en dubbele bindingen:
`` `
H
\
C
/ \
H C
\ /
C
/ \
H C
\ /
C
/ \
H H
`` `
2. Gedelokaliseerde elektronen: De dubbele bindingen in benzeen zijn niet in positie gefixeerd. In plaats daarvan worden de elektronen die betrokken zijn bij de dubbele bindingen over de hele ring gedelokaliseerd. Dit betekent dat de elektronen gelijk worden gedeeld door alle zes koolstofatomen.
3. Resonantiestructuren: We kunnen deze delocalisatie vertegenwoordigen door twee resonantiestructuren te tekenen, waar de dubbele bindingen worden verschoven:
`` `
H
\
C
/ \
H C
\ /
C =
/ \
H C
\ /
C =
/ \
H H
`` `
En
`` `
H
\
C =
/ \
H C
\ /
C
/ \
H C =
\ /
C
/ \
H H
`` `
4. Gelijke bindingslengtes: Omdat de elektronen worden gedelokaliseerd en de dubbele bindingen voortdurend verschuiven, zijn alle koolstof-koolstofbindingen in benzeen in wezen intermediair tussen een enkele en een dubbele binding. Dit resulteert in alle zes bindingen met dezelfde lengte, wat korter is dan een enkele binding maar langer dan een dubbele binding.
Samenvattend: De delocalisatie van elektronen in benzeen door resonantie leidt tot de gelijke koolstof-koolstofbindinglengte.
 Verbreken hoge temperaturen waterstofbruggen?
Verbreken hoge temperaturen waterstofbruggen?  Hoeveel gram chroom III -chloride is vereist om 75,0 g zilverchloride te produceren?
Hoeveel gram chroom III -chloride is vereist om 75,0 g zilverchloride te produceren?  De verandering die plaatsvindt wanneer twee of meer stoffen op elkaar inwerken om nieuw te vormen, wordt een reactie genoemd.?
De verandering die plaatsvindt wanneer twee of meer stoffen op elkaar inwerken om nieuw te vormen, wordt een reactie genoemd.?  Wat is het nut van flesjes?
Wat is het nut van flesjes?  Hoe converteer je ijs naar vloeibaar water?
Hoe converteer je ijs naar vloeibaar water?
Hoofdlijnen
- Wat eten we? Genetisch gemanipuleerde zalm goedgekeurd door de FDA
- Het langverwachte beleid van Chicago doet niet genoeg om trekvogels te beschermen, zeggen voorstanders
- Kunnen veel populaties in een ecosysteem dezelfde niche delen?
- Hoe wordt de hybride in allel waargenomen?
- Wat is mutualisme van een pinguïn?
- Een dierlijke cel die wordt omgeven door zoet water zal barsten omdat de osmotische druk veroorzaakt naar cel. Is dit waar?
- Welk principe verwijst naar de aanpassing van de Bodys, een bepaald type activiteit?
- De functie van de 4 nucleotiden gevonden in DNA?
- Hoe overleven verschillende organismen in biomen?
- Bevroren koper gedraagt zich als edelmetaal in katalyse:studie

- Chemici zien een vluchtige overgangstoestand van een reactie

- Nieuw membraan van twee polymeer verhoogt de prestaties van waterstofbrandstofcellen

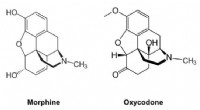
- Minder verslavende opioïden ontwerpen door middel van chemie
- Onderzoekers lokaliseren de grootste celreceptor van het lichaam
 Als de elektrische stroom wordt uitgeschakeld, valt het metaal dat aan de elektromagneet kleeft af. Leg uit waarom dit gebeurt?
Als de elektrische stroom wordt uitgeschakeld, valt het metaal dat aan de elektromagneet kleeft af. Leg uit waarom dit gebeurt?  Hoe reageren Grignard-reagentia met water?
Hoe reageren Grignard-reagentia met water?  Wat is afgeleide vegetatie?
Wat is afgeleide vegetatie?  Wat is het proces van het verkrijgen van kwantitatieve informatie over verschillende fenomenen?
Wat is het proces van het verkrijgen van kwantitatieve informatie over verschillende fenomenen?  Zeewier kan een winstgevend stuk worden in de groene transitiepuzzel
Zeewier kan een winstgevend stuk worden in de groene transitiepuzzel Dieptelading:atoomkrachtmicroscopie gebruiken om ondergrondse structuren te bestuderen
Dieptelading:atoomkrachtmicroscopie gebruiken om ondergrondse structuren te bestuderen Hoe snel reisde de asteroïde van Yucatan?
Hoe snel reisde de asteroïde van Yucatan?  Hoe grote kalkoengieren in de lucht blijven hangen
Hoe grote kalkoengieren in de lucht blijven hangen
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

