
Wetenschap
In alcl3.nh3 stikstof doneert een elektronegatief atoom een eenzaam paar aan elektropositief aluminium compleet octet. Hoe is dat mogelijk?
1. Het onvolledige octet van aluminium
* In ALCL3 heeft aluminium slechts 6 elektronen in zijn valentieschaal, waardoor het elektronentekort is. Dit komt omdat het 3 bindingen heeft met chloor, die elk één elektron bijdragen.
* De elektronenconfiguratie van aluminium is [NE] 3S² 3P¹. Het wil niet elektronengebrek zijn.
2. Het enige paar op stikstof
* Stikstof in ammoniak (NH3) heeft een eenzaam paar elektronen die het kan doneren. De elektronenconfiguratie is [He] 2s² 2p³.
3. Vorming van de coördinaatcovalente binding
* De sleutel is de coördinaatcovalente binding. Dit type obligatie ontstaat wanneer één atoom beide elektronen voor het gedeelde paar biedt.
* Stikstof schenkt zijn enige paar aan aluminium. Dit resulteert in een dative binding (ook bekend als een coördinaatcovalente binding) tussen de stikstof- en aluminiumatomen.
* Met deze donatie van elektronen kan aluminium een volledig octet bereiken.
4. Waarom het werkt
* Elektrontekort: Het aluminiumatoom in ALCL3 is elektron -deficiënt, waardoor het een goede elektronenacceptor is.
* Beschikbaarheid van eenzaam paar: Stikstof in ammoniak heeft een direct beschikbaar eenzaam paar om te doneren.
* stabiliteit: De vorming van de coördinaatcovalente binding leidt tot een stabielere structuur voor zowel ALCL3 als NH3.
Samenvattend:
De interactie tussen ALCL3 en NH3 gaat niet over het vullen van een al compleet octet op aluminium. Het gaat over aluminium, dat elektroneficiënt is, en een eenzaam paar van stikstof accepteert om een stabiel octet te bereiken.
 Tijdens het praktische in het laboratorium wanneer hydrozensulfidegas met een overgangen wordt gepringeerd voor een test, kunt u zelfs 50 mtr weg ruiken, het fenomeen verklaren?
Tijdens het praktische in het laboratorium wanneer hydrozensulfidegas met een overgangen wordt gepringeerd voor een test, kunt u zelfs 50 mtr weg ruiken, het fenomeen verklaren?  Hoe worden niet -metalen stabiel?
Hoe worden niet -metalen stabiel?  Waarom worden zilvernitraat en ethanol gebruikt in haloalkaanhydrolyse?
Waarom worden zilvernitraat en ethanol gebruikt in haloalkaanhydrolyse?  Bestaat er zoiets als niet-giftige stof?
Bestaat er zoiets als niet-giftige stof?  De beweging van fluorescerende sondes door het celmembraan stimuleren
De beweging van fluorescerende sondes door het celmembraan stimuleren
 Onderscheid maken tussen voor- en naschokken van aardbevingen
Onderscheid maken tussen voor- en naschokken van aardbevingen Zeegrasweiden - kritieke habitats voor jonge vissen en doejongs op de Johor-eilanden
Zeegrasweiden - kritieke habitats voor jonge vissen en doejongs op de Johor-eilanden Onderzoek toont aan hoe een eenvoudige maatstaf de wereldeconomie zou kunnen sturen in de richting van het stoppen en omkeren van het verlies aan biodiversiteit
Onderzoek toont aan hoe een eenvoudige maatstaf de wereldeconomie zou kunnen sturen in de richting van het stoppen en omkeren van het verlies aan biodiversiteit  Kenmerken van wijnstokken
Kenmerken van wijnstokken  Klimaatverandering kan de voedselketens in de oceaan veranderen, wat leidt tot veel minder vissen in de zee
Klimaatverandering kan de voedselketens in de oceaan veranderen, wat leidt tot veel minder vissen in de zee
Hoofdlijnen
- Waar worden stamcellen in het lichaam bewaard?
- Waar is het fenotype van een dier dat van is gemaakt?
- Wat is de wetenschappelijke naam voor een shag met blauwe ogen?
- Wat bestaat uit 4 uitspraken die het verband tussen cellen en levende wezens verklaren?
- Onderzoek toont aan hoe de wiskunde- en wetenschappelijke identiteit bij studenten de resultaten op de universiteit en carrière beïnvloedt
- Wat worden gevormde groepen cellen die samenwerken als organen in orgaansystemen?
- Wat is het effect van druk op enzymen?
- Onderzoek toont aan hoe de vogelgriep kan worden uitgeroeid door de genen van kippen te bewerken
- 245 miljoen jaar oude fossielen bieden nieuwe inzichten in de evolutie en voedingsstrategieën van waterinsecten
- een nieuwe, natuurlijke wascoating maakt kleding waterafstotend en ademend

- Een weg naar de toekomst, geplaveid met keramiek

- Onderzoekers rapporteren een temperatuurgevoelige gel die vocht absorbeert en afgeeft
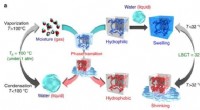
- Onderzoekers creëren smartphonesysteem om te testen op lood in water

- Suiker aan eiwit plakken
 Waar vind je boor op aarde?
Waar vind je boor op aarde?  Wanneer de hoeveelheid energie die wordt ontvangen uit de zon en teruggekeerd naar de ruimte, wordt ongeveer gelijk genoemd, wat wordt het genoemd?
Wanneer de hoeveelheid energie die wordt ontvangen uit de zon en teruggekeerd naar de ruimte, wordt ongeveer gelijk genoemd, wat wordt het genoemd?  Op nachten wanneer we een volle maan zien, welke kant van de zien?
Op nachten wanneer we een volle maan zien, welke kant van de zien?  Hoe label je momenteel de lagen Mount St Helens?
Hoe label je momenteel de lagen Mount St Helens?  Scholen in Bangkok gesloten vanwege zorgen over luchtvervuiling
Scholen in Bangkok gesloten vanwege zorgen over luchtvervuiling Waarnemingen onthullen een geïoniseerde halo van planetaire nevel IC 5148
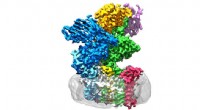
Waarnemingen onthullen een geïoniseerde halo van planetaire nevel IC 5148 Sterke signalen laten zien hoe eiwitten komen en gaan
Sterke signalen laten zien hoe eiwitten komen en gaan Hoe werkt een aqua-therm?
Hoe werkt een aqua-therm?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

