
Wetenschap
Is de pH van de oplossing een negatieve logaritme zijn hydroxide -ionenconcentratie?
De pH van een oplossing is de negatieve logaritme van zijn waterstofionconcentratie , niet de hydroxide -ionenconcentratie.
Hier is de uitsplitsing:
* pH: Een maat voor de zuurgraad of alkaliteit van een oplossing.
* waterstofionen (H+) :De ionen die verantwoordelijk zijn voor de zuurgraad.
* Hydroxide-ionen (OH-) :De ionen die verantwoordelijk zijn voor alkaliteit.
De relatie tussen pH en hydroxide -ionenconcentratie is via de POH -schaal:
* poh :De negatieve logaritme van de hydroxide -ionenconcentratie.
* Relatie tussen pH en POH: pH + POH =14 (bij 25 ° C)
Voorbeeld:
Als de pH van een oplossing 3 is, is de POH 11 (14 - 3 =11). U kunt vervolgens de hydroxide -ionenconcentratie berekenen van de POH:
[Oh-] =10^(-poh) =10^(-11) m
Samenvattend:
* pH: Meet waterstofionconcentratie (zuurgraad)
* poh: Meet hydroxide -ionenconcentratie (alkaliteit)
* pH en POH zijn gerelateerd door de vergelijking:pH + poh =14
 Waar komt de meeste vervuiling van de oceaan vandaan?
Waar komt de meeste vervuiling van de oceaan vandaan?  Wat is de standaard enthalpieverandering voor een reactie die het verbreken van alle bindingen in gasvormig benzeen betekent?
Wat is de standaard enthalpieverandering voor een reactie die het verbreken van alle bindingen in gasvormig benzeen betekent?  Wetenschappers onderzoeken toekomstig gebruik van op bacteriën gebaseerde actieve stoffen
Wetenschappers onderzoeken toekomstig gebruik van op bacteriën gebaseerde actieve stoffen Welke eigenschap van koolwaterstoffen die ze als brandstof nuttig maken?
Welke eigenschap van koolwaterstoffen die ze als brandstof nuttig maken?  Op welk molecuul bevindt zich het anticodon?
Op welk molecuul bevindt zich het anticodon?
 Woestijnvorming en klimaatverandering door moesson gekoppeld aan verschuivingen in ijsvolume en zeeniveau
Woestijnvorming en klimaatverandering door moesson gekoppeld aan verschuivingen in ijsvolume en zeeniveau Star Wars:De evolutie van de Death Star weerspiegelt de groeiende angst van Hollywood voor een klimaatapocalyps
Star Wars:De evolutie van de Death Star weerspiegelt de groeiende angst van Hollywood voor een klimaatapocalyps Recordbrekende kou komt naar Midwest na sneeuwstorm
Recordbrekende kou komt naar Midwest na sneeuwstorm Vijf jaar dorst:Zuid-Afrika Oost-Kaap bestrijdt brute droogte
Vijf jaar dorst:Zuid-Afrika Oost-Kaap bestrijdt brute droogte Zijn blikseminsecten een bedreigde soort? Niemand weet het
Zijn blikseminsecten een bedreigde soort? Niemand weet het
Hoofdlijnen
- Wat kunnen eiwitten doen?
- Welke functies worden gebruikt om een organisme te classificeren?
- Hoe kunnen een spiercel en zenuw zo verschillend zijn als ze allebei exact dezelfde set chromosomen bevatten?
- Wat is het verschil tussen computercel en biologische cel?
- Vogelneuronen gebruiken drie keer minder glucose dan zoogdierneuronen
- Voorbeelden van hittebestendige bacteriën
- Nieuw ontwikkelde schakelaar activeert genen duizenden keren beter dan de natuur
- Onderzoekers rapporteren een fundamentele spiersnelheidslimiet
- Wat is de structuur die door planten wordt gebruikt om voedsel te maken in een proces dat fotosynthese wordt genoemd?
- Biosensor-chip detecteert draadloos single-nucleotide polymorfisme, met hogere gevoeligheid
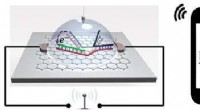
- Onderzoekers creëren slimme oppervlakken om bloedvattransplantaten beter te laten breien, veiliger

- Je volgende telefoonhoesje kan aanvoelen als een menselijke huid

- Koolmonoxide verandert onder omgevingsdruk in groot defectloos grafeenkristal

- Onderzoekers bepalen hoe alfavirus verandert in infectieuze toestand
 Wat is de instelling van planeten van Hitchhikers Guide to Galaxy?
Wat is de instelling van planeten van Hitchhikers Guide to Galaxy?  Welke elementen zijn in elk macromolecuul opgenomen?
Welke elementen zijn in elk macromolecuul opgenomen?  Hoe werkt oceaan -thermische energie -conversie - otec?
Hoe werkt oceaan -thermische energie -conversie - otec?  Snel, efficiënte en duurzame kunstmatige synaps ontwikkeld
Snel, efficiënte en duurzame kunstmatige synaps ontwikkeld Wat zijn cilindrische monsters van oceaansediment?
Wat zijn cilindrische monsters van oceaansediment?  Wat is zichtbare en onzichtbare energie samengesteld?
Wat is zichtbare en onzichtbare energie samengesteld?  Waarom is de verschillende afstand tussen zon en aarde goed voor het seizoen?
Waarom is de verschillende afstand tussen zon en aarde goed voor het seizoen?  Mensen die medemensen wantrouwen tonen meer vertrouwen in kunstmatige intelligentie
Mensen die medemensen wantrouwen tonen meer vertrouwen in kunstmatige intelligentie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

