
Wetenschap
Wat verliest zijn buitenste elektronen gemakkelijker broom of krypton?
* Elektronenconfiguratie: Bromine (BR) heeft een elektronenconfiguratie van [AR] 3D¹⁰ 4S² 4P⁵. Het heeft 7 valentie -elektronen, wat betekent dat het één elektron moet krijgen om een stabiel octet te bereiken. Krypton (KR) heeft een elektronenconfiguratie van [AR] 3D¹⁰ 4S² 4P⁶. Het heeft al een volledig octet van valentie -elektronen en is zeer stabiel.
* ionisatie -energie: Ionisatie -energie is de energie die nodig is om een elektron uit een atoom te verwijderen. Bromine heeft een lagere ionisatie -energie dan Krypton omdat het gemakkelijker is om een elektron uit een atoom te verwijderen dat geen volledig octet heeft. Krypton's stabiele, volledige octet maakt het veel moeilijker om een elektron te verwijderen.
Samenvattend: Bromine, dichter bij het bereiken van een stabiel octet, verliest zijn buitenste elektronen gemakkelijker dan Krypton, die zich al in een zeer stabiele toestand bevindt.
 VCU-uitvinders handapparaat brengt enorme verbeteringen aan het watertestproces
VCU-uitvinders handapparaat brengt enorme verbeteringen aan het watertestproces Wat is compound voor SBR6?
Wat is compound voor SBR6?  Worden er kristallen gevormd uit mineralen opgelost in vloeistoffen?
Worden er kristallen gevormd uit mineralen opgelost in vloeistoffen?  Waarom is het moeilijker om te testen op de aanwezigheid van chloride in organische verbindingen dan anorganisch zoals HCL?
Waarom is het moeilijker om te testen op de aanwezigheid van chloride in organische verbindingen dan anorganisch zoals HCL?  Welk element is stabiel met 2 valentie -elektronen?
Welk element is stabiel met 2 valentie -elektronen?
Hoofdlijnen
- Hoe wordt een zuivere cultuur direct voorbereid?
- Gespecialiseerde eilandjescellen die hormonen afscheiden worden verspreid over de?
- Cavendish redden:team kweekt 's werelds eerste ziekteresistente bananen in Panama
- Welke organel kan overleven en zich onafhankelijk van een cel voortplanten?
- Wat betekent replicatie in de biologie?
- Ingewikkelde ijsgrotten in Antarctica May Harbor Unique Life
- Heeft de toegenomen genduplicatie de weg geëffend voor de menselijke evolutie?
- Ambien
- Hoe organiseren wetenschappers dieren in groepen?
- Hightech oppervlakken kunnen de weerstand en CO2-uitstoot van schepen aanzienlijk verminderen

- Op zoek naar perfecte chemie - een visie voor verenigende katalyse
- Hot brew koffie heeft een hoger gehalte aan antioxidanten dan cold brew

- Gemodificeerde peptiden kunnen de groei en ontwikkeling van planten stimuleren
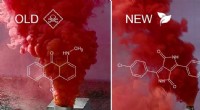
- Een groener alternatief voor roodgekleurde rook
 Welke apparatuur heeft een ruimtesonde aan boord?
Welke apparatuur heeft een ruimtesonde aan boord?  Waar zijn alle bloemen gebleven?
Waar zijn alle bloemen gebleven?  Gemiddelde scores gebruiken met punten
Gemiddelde scores gebruiken met punten  Wetenschappers vinden manier om mineraal te maken dat CO2 uit de atmosfeer kan verwijderen
Wetenschappers vinden manier om mineraal te maken dat CO2 uit de atmosfeer kan verwijderen Dodental stijgt terwijl tondeldroge omstandigheden dodelijke branden in Californië voeden
Dodental stijgt terwijl tondeldroge omstandigheden dodelijke branden in Californië voeden Wordt deze chemische vergelijking een verbrandingsreactie beschouwd en zo ja, waarom 4NA plus O2 is gelijk aan 2NAO2?
Wordt deze chemische vergelijking een verbrandingsreactie beschouwd en zo ja, waarom 4NA plus O2 is gelijk aan 2NAO2?  Wat zijn 3 klimaattypen in het Niger River Basin?
Wat zijn 3 klimaattypen in het Niger River Basin?  Van welk subatomair deeltje is een waterstofion gemaakt?
Van welk subatomair deeltje is een waterstofion gemaakt?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

