
Wetenschap
Wat is energiefactor voor ammoniumnitraat die ionen in water oplossen?
Dit is waarom:
* Endotherm vs. exotherme: Het oplossen van ammoniumnitraat in water is een endotherm proces. Dit betekent dat warmte wordt geabsorbeerd uit de omgeving, waardoor de oplossing koud aanvoelt.
* Enthalpy Change (ΔH): De enthalpieverandering voor het oplossen van ammoniumnitraat in water is positief . Een positieve AH duidt op een endotherme reactie.
* Factoren die de enthalpie -verandering beïnvloeden: De enthalpieverandering van het oplossen van ammoniumnitraat in water wordt beïnvloed door:
* Roosterergie: De energie houdt de ionen bij elkaar in het vaste ammoniumnitraat.
* Hydratatie -energie: De energie die vrijkomt wanneer de ionen worden omgeven door watermoleculen.
het berekenen van de enthalpiewijziging:
U kunt de enthalpieverandering van het oplossen van ammoniumnitraat in water experimenteel vinden of opzoeken in een referentietabel.
Opmerking: Het is belangrijk om onderscheid te maken tussen "enthalpie -verandering" en "energiefactor". De enthalpie -verandering kwantificeert de warmtestroom, terwijl "energiefactor" een minder specifieke term is die in verschillende contexten verschillende betekenissen kan hebben.
 Waarom zijn elementen die 1 elektron verkrijgen of verliezen de meest actieve metalen niet -metalen?
Waarom zijn elementen die 1 elektron verkrijgen of verliezen de meest actieve metalen niet -metalen?  Welke soort ontstaat wanneer het CH3N2 plus-kation een stikstofmolecuul verliest?
Welke soort ontstaat wanneer het CH3N2 plus-kation een stikstofmolecuul verliest?  Vast koper reageert met vaste zwavel om je sulfide te vormen?
Vast koper reageert met vaste zwavel om je sulfide te vormen?  Is puur water een zuur een basis geen of beide?
Is puur water een zuur een basis geen of beide?  Hoe het zoutgehalte van zeewater te meten
Hoe het zoutgehalte van zeewater te meten
 Acties om koraalriffen te redden kunnen alle ecosystemen ten goede komen
Acties om koraalriffen te redden kunnen alle ecosystemen ten goede komen Hoe beïnvloeden zeestromingen mensen?
Hoe beïnvloeden zeestromingen mensen?  Feiten over de Afrikaanse plaat
Feiten over de Afrikaanse plaat  Welk systeem wordt gebruikt om wetenschappelijk onderzoek te doen?
Welk systeem wordt gebruikt om wetenschappelijk onderzoek te doen?  Chinas EarthLab begint met proeven als eerste faciliteit van het land die interacties met het aardsysteem onderzoekt
Chinas EarthLab begint met proeven als eerste faciliteit van het land die interacties met het aardsysteem onderzoekt
Hoofdlijnen
- Hoe verschillen twee dochtercellen?
- Chromosomen vormen in wat?
- Waar bevinden lipiden zich in het lichaam?
- Hoe helpen bacteriën niet mensen?
- Wat is de gevaarlijkste cel?
- Is het waar dat alle planten op dezelfde manier doen?
- Geheimen van de naakte molrat:nieuw onderzoek onthult hoe hun unieke metabolisme hen beschermt tegen hartaanvallen
- Dennen kappen:eerder vroeger dan later doen is beter voor fynbos
- Welke kenmerken maken eiwitten de meest veelzijdige macromoleculen in cellen termen van functionele mogelijkheden?
- Wetenschappers gebruiken micro-organismen om functionele bacteriële cellulose in situ te fabriceren
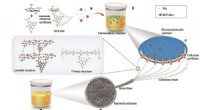
- Nieuw, goedkoop alternatief voor ethyleenproductie
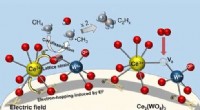
- Onderzoekers onderzoeken energiebesparende katalysatoren die werken bij kamertemperatuur

- Hoe ingesloten radicalen uit carboxyl te bevrijden?

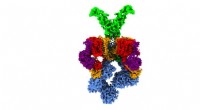
- Wetenschappers lossen 3D-structuur van nanomachine op die tuberculose virulent maakt
 Wat doet de betekenis van modderig getij?
Wat doet de betekenis van modderig getij?  Wat is de breedtegraad van Scorpius in graden?
Wat is de breedtegraad van Scorpius in graden?  Laos potten onthullen langzaam hun geheimen
Laos potten onthullen langzaam hun geheimen Wat zijn de voordelen en nadelen van endotherm zijn?
Wat zijn de voordelen en nadelen van endotherm zijn?  Hand- en voetafdrukkunst dateert uit het midden van de ijstijd
Hand- en voetafdrukkunst dateert uit het midden van de ijstijd Kun je alleen een regenboog zien met je rug naar de zon?
Kun je alleen een regenboog zien met je rug naar de zon?  Hoe weten geoloog dat rotslagen ongestoord zijn?
Hoe weten geoloog dat rotslagen ongestoord zijn?  Waarom reist bliksem niet in een rechte lijn?
Waarom reist bliksem niet in een rechte lijn?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

