
Wetenschap
Alkali metaalhydroxiden en alkalische aarde zijn?
* Alkali metaalhydroxiden: Dit zijn verbindingen gevormd door het combineren van een alkalimetaal (groep 1 op de periodieke tabel:lithium (Li), natrium (NA), kalium (K), rubidium (RB), cesium (CS) en Francium (FR)) met het hydroxide -ion (OH⁻).
* Voorbeelden: Natriumhydroxide (NaOH), kaliumhydroxide (KOH)
* eigenschappen: Het zijn sterke bases, wat betekent dat ze gemakkelijk hydroxide -ionen (OH⁻) in oplossing doneren. Ze zijn erg oplosbaar in water en produceren zeer alkalische oplossingen.
* Alkalische aardmetaalhydroxiden: Dit zijn verbindingen gevormd door het combineren van een alkalisch aardmetaal (groep 2 op het periodiek systeem:beryllium (BE), magnesium (mg), calcium (Ca), strontium (SR), barium (BA) en radium (RA)) met het hydroxide -ion (OH⁻).
* Voorbeelden: Calciumhydroxide (Ca (OH) ₂), magnesiumhydroxide (Mg (OH) ₂ ₂)
* eigenschappen: Ze zijn ook bases, maar over het algemeen zwakker dan alkali metaalhydroxiden. Hun oplosbaarheid in water varieert, waarvan sommige slechts enigszins oplosbaar zijn.
Sleutelpunten:
* Sterke bases: Alkali -metaalhydroxiden worden over het algemeen beschouwd als sterke basen omdat ze volledig in water worden gescheiden, waardoor een hoge concentratie hydroxide -ionen loslaten.
* zwakkere bases: Alkalische aardmetaalhydroxiden zijn meestal zwakkere basen omdat ze niet volledig in water dissociëren.
* Toepassingen: Beide soorten hydroxiden hebben tal van toepassingen, van industriële processen (zoals zeep maken) tot dagelijkse toepassingen (zoals antacida en bij het maken van beton).
Laat het me weten als je meer details wilt over specifieke alkali of alkalische aardmetaalhydroxiden of hun gebruik!
 Wat verklaart de eigenschappen van metaal?
Wat verklaart de eigenschappen van metaal?  Team zorgt voor stabiliteit van ontziltingsproces met magnesium
Team zorgt voor stabiliteit van ontziltingsproces met magnesium Chemische golven gids voor katalysatoren van de toekomst
Chemische golven gids voor katalysatoren van de toekomst Wetenschappers ontdekken mogelijke methode om de bacteriën die tuberculose veroorzaken uit te hongeren
Wetenschappers ontdekken mogelijke methode om de bacteriën die tuberculose veroorzaken uit te hongeren Plastic folie beschermt oppervlakken tegen nieuw coronavirus bij contact
Plastic folie beschermt oppervlakken tegen nieuw coronavirus bij contact
Hoofdlijnen
- Chromosoomorganisatie komt voort uit 1-D-patronen
- De opkomst van nieuwe soorten van een gemeenschappelijke voorouder die wordt geïntroduceerd en een diverse omgeving staat bekend als?
- Is een scavenger autotrofe of heterotrofe?
- Waarom veranderden soorten organismen in de loop van de tijd?
- Welk molecuul is het gemeenschappelijke vertakkingspunt voor anaërobe of aerobe route?
- Voorbeelden van archaebacteriën met hun wetenschappelijke naam en classificatie
- Hoe zijn enzymen gerelateerd aan macromoleculen en chemische reacties?
- Jaws:Hoe een Afrikaanse vis met roggenvin ons helpt de fundamenten van de evolutie te heroverwegen
- Wat is waar aan de genenpool en genetische diversiteit?
- Onderzoekers bepalen hoe alfavirus verandert in infectieuze toestand
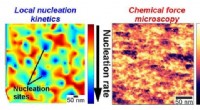
- Nucleatiekinetiek in kaart brengen met nanometerresolutie
- Studie kijkt naar ijs voor het vervaardigen van bruikbare poreuze materialen

- Wetenschappers ontwerpen veelbelovende nieuwe kathode voor op natrium gebaseerde batterijen

- Geheime berichten verborgen in lichtgevoelige polymeren
 Gelaatsschermen geen partij voor nieswervelringen
Gelaatsschermen geen partij voor nieswervelringen Astronomen observeren mysterieus dimmen van een jonge nabije ster
Astronomen observeren mysterieus dimmen van een jonge nabije ster Vanaf de hoogte van 8mts viel een bal naar beneden en elke keer stuitert hij de helft van de afstand terug wat wordt afgelegd?
Vanaf de hoogte van 8mts viel een bal naar beneden en elke keer stuitert hij de helft van de afstand terug wat wordt afgelegd?  Hoe werken systemen in het universum samen?
Hoe werken systemen in het universum samen?  Hoe weet u dat een object versnelt?
Hoe weet u dat een object versnelt?  Hoe deeltjesbeweging de warmteoverdracht door geleiding verklaart?
Hoe deeltjesbeweging de warmteoverdracht door geleiding verklaart?  Wat is de formule van lithium en stikstof?
Wat is de formule van lithium en stikstof?  2e grote sneeuwstorm in een week dekens Noordoost
2e grote sneeuwstorm in een week dekens Noordoost
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

