
Wetenschap
Wat is het volume van 72,0 gram zwaveldioxide?
1. Bepaal de molaire massa van SO₂
* Zwavel (s) heeft een molaire massa van 32,06 g/mol
* Zuurstof (O) heeft een molaire massa van 16,00 g/mol
* So₂ heeft een molaire massa van 32.06 + (16,00 x 2) =64,06 g/mol
2. Bereken het aantal mol So₂
* Mol =massa / molaire massa
* Mol =72,0 g / 64.06 g / mol
* Mol ≈ 1.124 mol
3. Pas de ideale gaswet toe
* De ideale gaswet is PV =nrt, waar:
* P =druk (in atmosferen)
* V =volume (in liters)
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (in kelvin)
4. U hebt meer informatie nodig
Om het volume te berekenen, moeten we de druk weten en temperatuur van het zwaveldioxidegas.
Voorbeeld:
Laten we aannemen dat het zwaveldioxide zich bij standaardtemperatuur en druk (STP) bevindt:
* T =273.15 K
* P =1 ATM
Nu kunnen we oplossen voor V:
* V =(nrt) / p
* V =(1.124 mol * 0,0821 l · atm / mol · k * 273.15 k) / 1 atm
* V ≈ 25.4 l
Daarom is het volume van 72,0 gram zwaveldioxide bij STP ongeveer 25,4 liter.
 Wat zijn enkele levende wezens in een regenwoud?
Wat zijn enkele levende wezens in een regenwoud?  Filippijnse vulkaanuitbarsting kan volgende winter leiden tot opwarming van El Nino
Filippijnse vulkaanuitbarsting kan volgende winter leiden tot opwarming van El Nino Welke invloed hebben productiekeuzes op de microvezelschuur?
Welke invloed hebben productiekeuzes op de microvezelschuur?  Hoe gebruiken mensen de meeste natuurlijke hulpbronnen?
Hoe gebruiken mensen de meeste natuurlijke hulpbronnen?  Zonne-geo-engineering kan effectief zijn bij het verlichten van de effecten van de opwarming van de aarde op gewassen
Zonne-geo-engineering kan effectief zijn bij het verlichten van de effecten van de opwarming van de aarde op gewassen
Hoofdlijnen
- Waarom verhuizen chloroplasten in Elodea?
- Wat zijn 3 voorbeelden van organismen die overblijfselen bevatten?
- Wie was de eerste persoon die ziektekiemen ontdekte?
- Hoe gistformaties ontstonden
- Vergelijk en vergelijk DNA en RNA
- Wat is verticale gelelektroforese -eenheid?
- Welke soorten cellen delen door mitose en cytokinese?
- Mannelijke spinnen laten zich van hun gevoelige kant zien
- De speekselklieren zijn samengesteld uit welke twee typen cellen?
- Het op maat maken van het oppervlak van koolstof kan de sleutel zijn tot het in realtime monitoren van het bloed van de patiënt

- Nanoplastics kunnen menselijke lever- en longcelprocessen verstoren in laboratoriumexperimenten
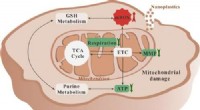
- Studie versnelt de transformatie van biobrandstofafval in bruikbare chemicaliën

- Nieuwe nanofotonische coating kan bijdragen aan thermisch beheer en contra-surveillance
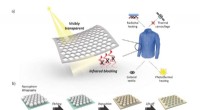
- Nieuwe computationele methode voor het ontdekken van medicijnen

 10 soorten fysieke verandering
10 soorten fysieke verandering  Team ontdekt quasar-tsunami's die de vorming van sterren kunnen voorkomen
Team ontdekt quasar-tsunami's die de vorming van sterren kunnen voorkomen Het publiek zegt dat ze meer vertrouwen op gerenommeerde nieuwsmerken om verkeerde informatie tegen te gaan
Het publiek zegt dat ze meer vertrouwen op gerenommeerde nieuwsmerken om verkeerde informatie tegen te gaan Noord-Amerikaans ijskapverval verminderde de klimaatvariabiliteit op het zuidelijk halfrond
Noord-Amerikaans ijskapverval verminderde de klimaatvariabiliteit op het zuidelijk halfrond De voordelen van MOSFET Over BJT
De voordelen van MOSFET Over BJT  Wat is het concept van wetenschap tegenwoordig?
Wat is het concept van wetenschap tegenwoordig?  Tot ziens, haring? Biotech-aas biedt kreeften een alternatief
Tot ziens, haring? Biotech-aas biedt kreeften een alternatief  Wat leeft in het water maar wordt nooit nat?
Wat leeft in het water maar wordt nooit nat?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

