
Wetenschap
Bevat koolstofdioxide een polaire of niet-polaire binding?
* Polaire bindingen: Zuurstof is elektronegatiefer dan koolstof, wat betekent dat het elektronen sterker aantrekt. Dit creëert een gedeeltelijke negatieve lading (Δ-) op de zuurstofatomen en een gedeeltelijke positieve lading (Δ+) op het koolstofatoom binnen elke C =O-binding.
* Niet-polair molecuul: Het CO2 -molecuul is lineair, met de twee zuurstofatomen aan weerszijden van het koolstofatoom. Deze symmetrische opstelling zorgt ervoor dat de polaire bindingen elkaar annuleren, wat resulteert in een niet-polair molecuul in het algemeen.
Zie het als een touwtrekken:de zuurstofatomen trekken de elektronen in de binding aan, maar omdat ze in tegengestelde richtingen trekken, balanceren ze elkaar.
Hoofdlijnen
- Welk organisme kan eigen voedsel produceren?
- Welke structuur in de cel is chemische messenger voor DNA?
- Wat gebeurt er met een eiwitmolecuul tijdens de vertering?
- Hoe spieren zich ontwikkelen:een dans van cellulaire skeletten
- Wetenschappers die biotechnologieën ontwikkelen, gebruiken vaak vectoren in hun onderzoek. Welke uitspraak beschrijft het beste wat een vector is?
- Welk deel van het zaad ontwikkelt zich tot een zaailing op tijdstip kieming?
- Aan het begin van de metafase zijn alle chromosomen?
- Wat zijn de chromosomen van het vrouwelijke geslacht in genetica?
- In de genetische code worden sommige aminozuren niet gespecificeerd door codons?
- Monstervoorbereiding in forensische toxicologische analyse kan enorme gevolgen hebben

- X-ray laser sight onthult medicijndoelen

- Microfluïdische chip kan bijwerkingen van radiotherapie verminderen
- Moleculaire bindingen smeden met groen licht

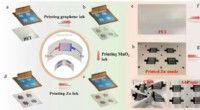
- Hoge veiligheid, flexibele en schaalbare oplaadbare planaire microbatterijen
 Terugbetaling besteld voor Oostenrijkse autokoper via Dieselgate
Terugbetaling besteld voor Oostenrijkse autokoper via Dieselgate Verouderde koolstofkredieten van oude wind- en zonneparken bedreigen de inspanningen op het gebied van klimaatverandering
Verouderde koolstofkredieten van oude wind- en zonneparken bedreigen de inspanningen op het gebied van klimaatverandering Moleculaire dynamische simulatie werpt nieuw licht op de vorming van methaanhydraat
Moleculaire dynamische simulatie werpt nieuw licht op de vorming van methaanhydraat Wat is de pH van een oplossing met hydroxide-ionenconcentratie 3,7 x 10-5?
Wat is de pH van een oplossing met hydroxide-ionenconcentratie 3,7 x 10-5?  Nieuwe quick-fix wrap kan bestaande structuren repareren en versterken
Nieuwe quick-fix wrap kan bestaande structuren repareren en versterken Welk bodemtype is het meest kwetsbaar voor winderosie?
Welk bodemtype is het meest kwetsbaar voor winderosie?  Hoe weten we wanneer een bedreigde soort zich heeft hersteld? Het is niet alleen een kwestie van cijfers
Hoe weten we wanneer een bedreigde soort zich heeft hersteld? Het is niet alleen een kwestie van cijfers  Wat is het hydraat in koolhydraten en kritisch molecuul voor hydrolysepolymerisatie?
Wat is het hydraat in koolhydraten en kritisch molecuul voor hydrolysepolymerisatie?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


