
Wetenschap
Hoeveel mol ammoniumionen zijn er in 6.965 carbonaat?
1. Bepaal de formule van ammoniumcarbonaat
Ammoniumcarbonaat heeft de formule (NH₄) ₂co₃. Dit betekent dat het bevat:
* Twee ammoniumionen (NH₄⁺)
* Eén carbonaation (co₃²⁻)
2. Vind de molaire massa van ammoniumcarbonaat
* N:14.01 g/mol * 2 =28.02 g/mol
* H:1.01 g/mol * 8 =8,08 g/mol
* C:12.01 g/mol * 1 =12.01 g/mol
* O:16.00 g/mol * 3 =48,00 g/mol
Totale molaire massa van (NH₄) ₂co₃ =28.02 + 8.08 + 12.01 + 48.00 = 96.11 g/mol
3. Bereken de mol ammoniumcarbonaat
Stel dat u 6,965 g ammoniumcarbonaat hebt:
Mol =massa / molaire massa
Moles =6,965 g/96.11 g/mol = 0,0725 mol (NH₄) ₂co₃
4. Bepaal de mol ammoniumionen
Omdat elke mol ammoniumcarbonaat twee mol ammoniumionen bevat:
Mol NH₄⁺ =0,0725 mol (NH₄) ₂co₃ * 2 mol NH₄⁺ / 1 mol (NH₄) ₂co₃ = 0,145 mol NH₄⁺
Daarom zijn er 0,145 mol ammoniumionen in 6,965 gram ammoniumcarbonaat.
 Wat is de evenwichtige vergelijking voor natriumnitraatnitriet en zuurstof?
Wat is de evenwichtige vergelijking voor natriumnitraatnitriet en zuurstof?  Is keukenzout uniform of niet-uniform?
Is keukenzout uniform of niet-uniform?  Welke massa NH3 heb je bereid uit de reactie van 10 g N2 met een overmaat aan H2?
Welke massa NH3 heb je bereid uit de reactie van 10 g N2 met een overmaat aan H2?  Belangrijke buffers in levende systemen
Belangrijke buffers in levende systemen Neemt de snelheid waarmee een gesteente chemische verwering ondergaat toe of blijft het hetzelfde als het mechanisch verweerder wordt, waarom?
Neemt de snelheid waarmee een gesteente chemische verwering ondergaat toe of blijft het hetzelfde als het mechanisch verweerder wordt, waarom?
 Voedselbezorgers in Frankrijk beloven afval te verminderen
Voedselbezorgers in Frankrijk beloven afval te verminderen Hoe bereid je je nu voor op de volgende extreme hittegolf
Hoe bereid je je nu voor op de volgende extreme hittegolf Eerder niet-herkend tsunami-gevaar geïdentificeerd in kuststeden
Eerder niet-herkend tsunami-gevaar geïdentificeerd in kuststeden Vulkanische kristallen geven een nieuwe kijk op magma
Vulkanische kristallen geven een nieuwe kijk op magma Hoe categoriseer je een tornado als weergerelateerd geologisch van aard en/of veroorzaakt door mensen?
Hoe categoriseer je een tornado als weergerelateerd geologisch van aard en/of veroorzaakt door mensen?
Hoofdlijnen
- Wat is de semantische organisatie van de menselijke taal?
- Heeft de kleinste levende organismen weefsel?
- Wat is het principe van glucose-6-fosfaatdehydrogenase?
- 'ZIP'-codes vertellen RNA-moleculen hoe ze hun aangewezen locaties kunnen bereiken
- Wat zijn de soorten dierenwetenschappers?
- Simpele microscoopexperimenten
- Wat zijn dochtercellen geproduceerd wanneer ze mitose ondergaan, genetisch zijn?
- Pissebedden hebben het nieuwe record voor de kleinste verspreiders van ingenomen zaden
- Onderzoek naar stafylokok laat zien hoe bacteriën resistentie ontwikkelen
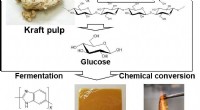
- De hoogste hittebestendige kunststof ooit is ontwikkeld uit biomassa
- Gels gemaakt van druppeltjes zijn minder stabiel dan gels gemaakt van vaste deeltjes

- Natuurkundigen meten moleculaire elektronische eigenschappen van vitamines

- Nieuw iongeleidend membraan verbetert alkaline-zink-ijzerstroombatterijen

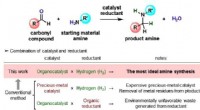
- Het naderen van een ideale aminozuursynthese met behulp van waterstof
 Wat is de dunne structuur die de kern omringt en beschermt?
Wat is de dunne structuur die de kern omringt en beschermt?  Welke handen die op een op batterijen werkende klok zijn, is een voorbeeld van wat voor soort energie?
Welke handen die op een op batterijen werkende klok zijn, is een voorbeeld van wat voor soort energie?  Hoe ver kun je op plat land zien?
Hoe ver kun je op plat land zien?  Pandemie legde grote problemen bloot voor de beschikbaarheid van middelen en het welzijn van vluchtelingen voor de geestelijke gezondheid
Pandemie legde grote problemen bloot voor de beschikbaarheid van middelen en het welzijn van vluchtelingen voor de geestelijke gezondheid Welke transformatie van energie gebeurt in rollend speelgoed?
Welke transformatie van energie gebeurt in rollend speelgoed?  Wat heeft meer massa, een steen met een volume van 1 ml of 4 ml?
Wat heeft meer massa, een steen met een volume van 1 ml of 4 ml?  Noordoost-gouverneurs traag om regionaal klimaatpact te omarmen
Noordoost-gouverneurs traag om regionaal klimaatpact te omarmen Nanocage-oppervlakken krijgen een make-over bij kamertemperatuur
Nanocage-oppervlakken krijgen een make-over bij kamertemperatuur
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

