
Wetenschap
Waarom lost natrium op in water maar koper niet?
Natrium (NA):
* Reactiviteit: Natrium is een zeer reactief alkalimetaal. Het verliest gemakkelijk zijn buitenste elektron om een positief geladen ion (Na+) te vormen.
* reactie met water: Wanneer natrium in contact komt met water, treedt een krachtige reactie op. Het natriumatoom doneert zijn elektron aan een watermolecuul en vormt een natriumion (Na+) en een hydroxide-ion (OH-). Deze reactie geeft een significante hoeveelheid energie vrij, waardoor het natrium vaak smelt en zelfs ontstoken.
* Vorming van natriumhydroxide: De natriumionen en hydroxide -ionen reageren verder op het vormen van natriumhydroxide (NaOH), die oplosbaar is in water. Dit lost het natrium volledig op.
koper (Cu):
* Lagere reactiviteit: Koper is een overgangsmetaal en is minder reactief dan natrium. Het houdt zijn elektronen steviger vast.
* Geen significante reactie: Hoewel koper kan reageren met bepaalde zuren (zoals salpeterzuur), reageert het niet gemakkelijk met water. De reactie met water is niet energetisch gunstig genoeg om de sterke metalen binding in koper te overwinnen.
* oxidatie: Koper oxideert (reageert met zuurstof) in aanwezigheid van lucht en vocht, waardoor een groene patina (koperoxide) wordt gevormd. Deze patina fungeert als een beschermende laag, waardoor verdere oxidatie wordt voorkomen.
Samenvattend: Natrium lost op in water vanwege zijn hoge reactiviteit en de neiging om ionen te vormen die gemakkelijk oplossen in water. Koper, minder reactief, ondergaat geen significante reactie met water en de oxidatie ervan in lucht vormt een beschermende laag die verdere reactie voorkomt.
 Covid-19-beperkende inspanningen kunnen de VS op het goede spoor zetten om de doelstellingen van het klimaatakkoord van Parijs te halen
Covid-19-beperkende inspanningen kunnen de VS op het goede spoor zetten om de doelstellingen van het klimaatakkoord van Parijs te halen Simulatie suggereert twee pluimen die betrokken zijn bij de productie van Deccan Traps
Simulatie suggereert twee pluimen die betrokken zijn bij de productie van Deccan Traps Wat is het broeikaseffect? Is het inherent slecht?
Wat is het broeikaseffect? Is het inherent slecht?  Klimaatverandering kan leiden tot sterke zeespiegelstijging
Klimaatverandering kan leiden tot sterke zeespiegelstijging Onderzoekers onderzoeken de ouderdom van grondwater in Egyptische watervoerende lagen
Onderzoekers onderzoeken de ouderdom van grondwater in Egyptische watervoerende lagen
Hoofdlijnen
- Wat is een goed wetenschappelijk schrijven?
- Natuuronderzoek laat zien hoe moleculen uit de kern ontsnappen
- Wat zijn de drie belangrijkste functies van sensorische informatie?
- Hoe reageren mannen en vrouwen op gendervooroordelen in STEM?
- Wat zijn observaties en gegevens waarop een wetenschappelijke verklaring kan zijn gebaseerd?
- Welke kleur heeft micrococcus luteus?
- De sites waar DNA -replicatie en scheiding plaatsvinden, worden opgeroepen?
- Nieuw onderzoek laat zien hoe parasieten complexe voedselwebben vormen
- Soort wetenschap die alle vormen bestudeert, is belangrijk?
- Nanoporiën maken draagbare massaspectrometer voor peptiden werkelijkheid
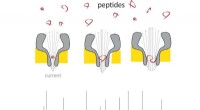
- Door bacteriële enzymen te kopiëren, lab leert snel nieuwe klasse antibiotica moleculen schoon te synthetiseren, efficiënt

- Wetenschappers verbeteren kleur en textuur van kweekvlees

- Transparant hout kan warmte opslaan en afgeven

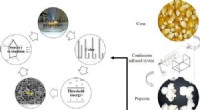
- Grote, smakelijke popcornpitten met infrarood koken
 Wat is de functiebeschrijving voor een mariene biologen?
Wat is de functiebeschrijving voor een mariene biologen?  Als een 130 N -koffer een afstand van 250 m wordt gesleept bij constante snelheidskracht 60 uitgeoefend 40 graden boven de horizontale. Hoeveel werk wordt gedaan. B klaar?
Als een 130 N -koffer een afstand van 250 m wordt gesleept bij constante snelheidskracht 60 uitgeoefend 40 graden boven de horizontale. Hoeveel werk wordt gedaan. B klaar?  Wat zijn de temperatuurpatronen van Alaska?
Wat zijn de temperatuurpatronen van Alaska?  Digitale ruimtes omarmen:hoe oudere immigranten door de infodemie navigeren
Digitale ruimtes omarmen:hoe oudere immigranten door de infodemie navigeren  Glasvezelkabels gebruiken om aardbevingen te detecteren
Glasvezelkabels gebruiken om aardbevingen te detecteren Atomen in grammen omrekenen met een rekenmachine
Atomen in grammen omrekenen met een rekenmachine Microscopische planten in de oceanen - diatomeeën - vangen koolstofdioxide op via biofysische paden
Microscopische planten in de oceanen - diatomeeën - vangen koolstofdioxide op via biofysische paden Klotsende kwantumvloeistoffen van licht en materie om superfluïditeit te onderzoeken
Klotsende kwantumvloeistoffen van licht en materie om superfluïditeit te onderzoeken
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

