
Wetenschap
Natrium- en chloride -atomen combineren gemakkelijk omdat ze allebei de neiging hebben elektronen te verliezen?
* natrium (na) Heeft een enkel elektron in zijn buitenste schaal. Het gemakkelijk verliest Dit elektron om een stabiele elektronenconfiguratie te bereiken zoals die van neon.
* chloor (Cl) heeft zeven elektronen in zijn buitenste schaal. Het is gemakkelijk wint Een elektron om een stabiele elektronenconfiguratie te bereiken zoals die van Argon.
De reden dat natrium en chloor gemakkelijk combineren, is te wijten aan hun tegengestelde neigingen:
* Natrium wil een elektron verliezen (om positief geladen te worden)
* Chloor wil een elektron winnen (om negatief geladen te worden)
Dit verschil in elektronegativiteit (de neiging om elektronen aan te trekken) creëert een elektrostatische aantrekkingskracht tussen de natrium- en chloride -ionen, waardoor het ionische samengestelde natriumchloride (NaCl) of tafelzout wordt gevormd.
 Klimaatverandering, ongedierte, omgevallen bomen een dodelijk recept voor Amerikaanse bossen
Klimaatverandering, ongedierte, omgevallen bomen een dodelijk recept voor Amerikaanse bossen Gezondheid van bomen gekoppeld aan reactie van vogels op klimaatverandering
Gezondheid van bomen gekoppeld aan reactie van vogels op klimaatverandering Hoe verandert de wetenschap Kerstmis?
Hoe verandert de wetenschap Kerstmis?  Wat zijn de kleuren in een pauwenveren?
Wat zijn de kleuren in een pauwenveren?  De missie om een mysterieuze aerosollaag boven de Himalaya-moessonwolken te ontcijferen
De missie om een mysterieuze aerosollaag boven de Himalaya-moessonwolken te ontcijferen
Hoofdlijnen
- Wat is een woord voor bacteriën?
- Waarom twee cellen ontmoeten wat is het gekaled?
- Verrassend snelle evolutie waargenomen bij hagedissoorten
- Wetenschappers laten zien hoe enkele van de vroegste dieren op aarde evolueerden
- Is Leucocyten kleurloos deel in je lichaam?
- Hoe babyvissen een thuis vinden
- Wat is de bijnaam voor mitochondria?
- P53 (TP53) Tumor Protein: Function, Mutation
- Welke wetenschapper bedacht de term cel na het bekijken van kurkcellen als een ruwe microscoop?
- Nieuwe synthetische route voor productie van biobrandstoffen

- De weg verlichten om van chemische reactiepaden te wisselen

- Moeilijk, sterk en hittebestendig:bio-geïnspireerd materiaal ter vervanging van plastic

- Wetenschappers analyseren 3D-model van eiwitten van ziekteverwekkende bacteriën
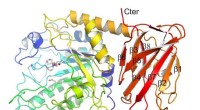
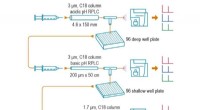
- Verbeterde eiwitanalyse kan vroege ziektedetectie helpen
 Wetenschappers waarschuwen G7 dat de kosten van het overschrijden van de 1,5˚C opwarmingslimiet veel hoger zullen zijn dan de kosten om het te bereiken
Wetenschappers waarschuwen G7 dat de kosten van het overschrijden van de 1,5˚C opwarmingslimiet veel hoger zullen zijn dan de kosten om het te bereiken Waarom teruggaan naar de maan?
Waarom teruggaan naar de maan?  Hoeveel schade kan een mogelijke vulkaanuitbarsting in IJsland veroorzaken?
Hoeveel schade kan een mogelijke vulkaanuitbarsting in IJsland veroorzaken?  Fotosynthese onder andere lichtomstandigheden dan de aarde
Fotosynthese onder andere lichtomstandigheden dan de aarde Wat vertegenwoordigen atomaire cijfers?
Wat vertegenwoordigen atomaire cijfers?  Welke structuren duwen en trekken de chromosomen op hun plaats tijdens de celdeling?
Welke structuren duwen en trekken de chromosomen op hun plaats tijdens de celdeling?  Wat is de dimensie voor kinetische energie?
Wat is de dimensie voor kinetische energie?  Onderzoekers onderzoeken achteruitgang van Zuid-Afrikaanse bosvogels
Onderzoekers onderzoeken achteruitgang van Zuid-Afrikaanse bosvogels
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

