
Wetenschap
Wat is de pH van ammoniumhydroxide?
Dit is waarom:
* evenwicht: Ammoniumhydroxide (NH₄OH) bestaat in evenwicht met ammoniak (NH₃) en water (H₂o). Deze evenwichtsreactie bepaalt de concentratie van hydroxide -ionen (OH⁻), die direct de pH beïnvloedt.
* concentratie: Hoe hoger de concentratie ammoniumhydroxide, hoe meer hydroxide -ionen aanwezig zijn, wat resulteert in een hogere pH (meer basic).
* variabele pH: Een verdunde oplossing van ammoniumhydroxide heeft een pH dichter bij 7 (neutraal), terwijl een geconcentreerde oplossing een pH hoger dan 7 (Basic) heeft.
Om de exacte pH van een specifieke oplossing van ammoniumhydroxide te bepalen, moet u de concentratie ervan kennen en de juiste evenwichtsconstante (KB) gebruiken voor de reactie.
Hier is een algemeen idee van het pH -bereik voor ammoniumhydroxide -oplossingen:
* Verdun oplossingen: pH rond 10-11
* Geconcentreerde oplossingen: pH rond 12-13
Vergeet niet dat dit geschatte waarden zijn en dat de werkelijke pH kan variëren, afhankelijk van de specifieke concentratie van de oplossing.
 Onderzoek naar de impact van klimaatverandering op de productie in China voorspelt aanzienlijke verliezen tegen het midden van de 21e eeuw
Onderzoek naar de impact van klimaatverandering op de productie in China voorspelt aanzienlijke verliezen tegen het midden van de 21e eeuw Onderwaardering van verborgen voordelen van rivieren ondermijnt economieën en duurzame ontwikkeling
Onderwaardering van verborgen voordelen van rivieren ondermijnt economieën en duurzame ontwikkeling Wat is het verschil in de betekenis tussen aanpassing en natuurlijke selectie?
Wat is het verschil in de betekenis tussen aanpassing en natuurlijke selectie?  Broeikasgassen van rijstvelden mogelijk 2x hoger dan gedacht
Broeikasgassen van rijstvelden mogelijk 2x hoger dan gedacht Empowerment van vrouwen kan helpen de klimaatverandering aan te pakken
Empowerment van vrouwen kan helpen de klimaatverandering aan te pakken
Hoofdlijnen
- Biologen maken toolkit voor het afstemmen van genetische circuits
- Video:Hoe drakenbloed je leven kan redden
- Wat is de vetceltheorie?
- Nu kunnen onderzoekers zien hoe ongevouwen eiwitten in de cel bewegen
- Hoe en waarom evolueerde homoseksueel gedrag bij mensen en andere dieren?
- Virussen herbedraden cellulaire machines van de gastheer om de virale productie te maximaliseren
- Een nieuwe diagnose voor de diagnostiek en behandeling van visherpesvirussen
- Het is belangrijk om bij het trekken van conclusies uit wetenschappelijke informatie?
- Produceert het rode beenmerg bloed?
- Nieuwe inzichten in hoe cyanobacteriën de zinkopname in de open oceaan reguleren
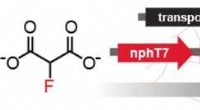
- Fluorbevattende moleculen uit celculturen
- Versleutelde, one-touch, mens-machine-interfacetechnologie onthult gebruikersfysiologie

- Een nieuwe gelelektroforesetechniek voor snelle biomarkerdiagnose via massaspectrometrie

- Klimaatvriendelijke architectuur dankzij natuurlijke vouwmechanismen

 Wat is zwaartekrachtenergie-?
Wat is zwaartekrachtenergie-?  10 Gebruik van alfastraling
10 Gebruik van alfastraling Wat betekent het atoom aantal stikstof?
Wat betekent het atoom aantal stikstof?  Webb detecteert de verste samensmelting van zwarte gaten tot nu toe
Webb detecteert de verste samensmelting van zwarte gaten tot nu toe  De nieuwste klimaatmodellen laten zien dat er nog meer intense droogtes op komst zijn
De nieuwste klimaatmodellen laten zien dat er nog meer intense droogtes op komst zijn  Hoe Stephen Hawking werkte
Hoe Stephen Hawking werkte  Welk type fossiel wordt gevormd wanneer een organisme vastloopt in een zich ontwikkelende rotslaag en vervolgens vervalt en de afdruk achterlaat van hoe het eruit zag?
Welk type fossiel wordt gevormd wanneer een organisme vastloopt in een zich ontwikkelende rotslaag en vervolgens vervalt en de afdruk achterlaat van hoe het eruit zag?  Wat is het materiaal van rj45?
Wat is het materiaal van rj45?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

