
Wetenschap
Leg uit hoe een chemische binding ontstaat tussen kalium en chloor?
Inzicht in de spelers:
* kalium (k): Een alkalimetaal, kalium heeft één elektron in zijn buitenste schaal (valentie -elektron). Het verliest gemakkelijk dit elektron om een stabiele, gevulde buitenste schaal te bereiken.
* chloor (CL): Een halogeen, chloor heeft zeven elektronen in zijn buitenste schaal. Het heeft nog een elektron nodig om een stabiele, gevulde buitenschaal te bereiken.
De ionische bindingsvorming:
1. Elektronenoverdracht: Wanneer kalium- en chlooratomen in de buurt komen, wordt het enkele valentie -elektron van kalium overgebracht naar de buitenste schaal van chloor.
2. ionenvorming:
* Kalium, na een elektron te hebben verloren, wordt een positief geladen ion (k+).
* Chloor, na een elektron te hebben gewonnen, wordt een negatief geladen ion (Cl-).
3. Elektrostatische aantrekkingskracht: De tegengesteld geladen ionen (k+ en cl-) worden tot elkaar aangetrokken vanwege elektrostatische krachten. Deze sterke aantrekkingskracht vormt een ionische binding .
4. Vorming van KCl: De elektrostatische aantrekkingskracht tussen het kalium- en chloride -ionen creëert een stabiele kristallijne structuur genaamd kaliumchloride (KCL). Deze structuur wordt bij elkaar gehouden door de sterke krachten tussen de tegengesteld geladen ionen.
Sleutelpunten:
* Ionische bindingen worden gevormd door de volledige overdracht van elektronen tussen atomen.
* De resulterende ionen worden bij elkaar gehouden door elektrostatische aantrekkingskracht.
* Ionische verbindingen hebben meestal hoge smelt- en kookpunten vanwege de sterke ionische bindingen.
* Kaliumchloride is een gewoon zout dat in verschillende toepassingen wordt gebruikt, waaronder meststoffen en voedseladditieven.
Samenvattend: De sterke elektrostatische aantrekkingskracht tussen de positief geladen kaliumion (K+) en het negatief geladen chloride-ion (Cl-) creëert de ionische binding in kaliumchloride (KCL).
 Waarom vertonen lanthaniden vergelijkbaar chemisch gedrag?
Waarom vertonen lanthaniden vergelijkbaar chemisch gedrag?  Van defecten naar orde:spontaan opkomende kristalarrangementen in perovskiethalogeniden
Van defecten naar orde:spontaan opkomende kristalarrangementen in perovskiethalogeniden  Wat is een verklaring van de Tweede Wet -thermodynamica?
Wat is een verklaring van de Tweede Wet -thermodynamica?  Hoe kan ik een NaOH-oplossing van 10 ppm bereiden?
Hoe kan ik een NaOH-oplossing van 10 ppm bereiden?  Hoe wordt een corrosieve alkali genoemd welke 7 letters?
Hoe wordt een corrosieve alkali genoemd welke 7 letters?
 De geschiedenis van de landbouw in de Amazone volgen
De geschiedenis van de landbouw in de Amazone volgen Explainer:Waarom het maanden duurt om enkele bosbranden te bedwingen
Explainer:Waarom het maanden duurt om enkele bosbranden te bedwingen Nieuwe landbewegingskaart toont de menselijke impact op het Britse landschap
Nieuwe landbewegingskaart toont de menselijke impact op het Britse landschap Zeespiegelstijging vraagt extra beheer om kwelders in stand te houden
Zeespiegelstijging vraagt extra beheer om kwelders in stand te houden 3,5 procent van de wereldwijde methaanafzettingen zou tegen 2100 kunnen zijn gesmolten als gevolg van klimaatverandering
3,5 procent van de wereldwijde methaanafzettingen zou tegen 2100 kunnen zijn gesmolten als gevolg van klimaatverandering
Hoofdlijnen
- Wat zijn de verschillen tussen een plant en een dierlijke cel onder een microscoop?
- Hoe duikende lederschildpadden het drijfvermogen reguleren
- Hoe wordt genetische informatie van de ene generatie op de andere doorgegeven?
- Een nieuwe draai aan de manier waarop parasieten gastheercellen binnendringen
- Basiscelfuncties
- Wat is een wetenschapper die overstromingen bestudeert?
- Uit welk deel van een plant komt groenten?
- In welke staten dat elk genpaar onafhankelijk van de paren wordt geërfd voor andere eigenschappen?
- Wat is de wetenschappelijke naam voor plantenbug?
- Onderzoek naar celisolatie levert veelbelovende resultaten op

- Een nieuwe composiet voor treksterkte
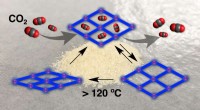
- Nieuwe kooldioxide-adsorberende kristallen voor biomedische materialen die afhankelijk zijn van vormgeheugeneffect
- Gezondheidsbehandeling door chemische synthese

- Onderzoekers ontwikkelen snelle en eenvoudige methode voor glyfosaatdetectie

 Is jodium een verbinding of mengsel?
Is jodium een verbinding of mengsel?  Een kinderwetenschappelijk project over wolken met katoenen ballen
Een kinderwetenschappelijk project over wolken met katoenen ballen Is een bewegingsdiagram dat het van een object weergeeft dat afbeeldingen over gelijke tijdsintervallen gebruikt?
Is een bewegingsdiagram dat het van een object weergeeft dat afbeeldingen over gelijke tijdsintervallen gebruikt?  Wanneer rotsen breken, bewegen ze zich langs het oppervlak.
Wanneer rotsen breken, bewegen ze zich langs het oppervlak.  Hoe koel je een stad in een opwarmende wereld?
Hoe koel je een stad in een opwarmende wereld? Welke oplosmiddelen zijn giftig?
Welke oplosmiddelen zijn giftig?  Wat zijn de drie dingen die de grootte van Coriolis Force afhangt?
Wat zijn de drie dingen die de grootte van Coriolis Force afhangt?  Indringende vraag:Wat voorspelt een gelukkig huwelijk?
Indringende vraag:Wat voorspelt een gelukkig huwelijk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

