
Wetenschap
Waarom vertonen lanthaniden vergelijkbaar chemisch gedrag?
1. Vergelijkbare elektronische configuraties:
* Alle lanthaniden hebben dezelfde buitenste elektronische configuratie van [xe] 4f n 5d 0-1 6s 2 , waarbij 'n' varieert van 1 tot 14, overeenkomend met het vullen van de 4F -orbitalen.
* De 4F -elektronen worden afgeschermd door de gevulde 5s- en 5p -orbitalen, waardoor ze minder betrokken zijn bij chemische binding.
* Daarom worden de chemische eigenschappen van lanthaniden grotendeels bepaald door de betrokkenheid van de 6S -elektronen.
2. Contractie van Lanthanide -serie:
* Terwijl u over de Lanthanider -serie beweegt, neemt de nucleaire lading toe, maar het afschermingseffect blijft grotendeels constant vanwege het slechte afschermingsvermogen van 4F -elektronen.
* Dit leidt tot een geleidelijke afname van de ionische straal van lanthaniden, bekend als de lanthanide -contractie.
* Deze samentrekking, hoewel klein, beïnvloedt de sterkte van de elektrostatische aantrekkingskracht tussen het lanthanide -ion en liganden.
3. Voornamelijk +3 oxidatietoestand:
* Lanthaniden hebben de neiging om een +3 oxidatietoestand te hebben vanwege het verlies van de twee 6s -elektronen en één 4F -elektron.
* Deze consistente oxidatietoestand draagt bij aan hun vergelijkbare reactiviteit.
4. Soortgelijke ionische radii:
* Vanwege de lanthanide -samentrekking zijn de ionische stralen van aangrenzende lanthaniden zeer vergelijkbaar.
* Met deze gelijkenis in ionische grootte kunnen ze vergelijkbare verbindingen vormen en vergelijkbare coördinatienummers vertonen.
5. Hoge coördinatienummers:
* Lanthaniden vormen typisch coördinatiecomplexen met hoge coördinatienummers (bijv. 8, 9, 10).
* Dit komt door hun grote omvang en beschikbaarheid van lege orbitalen in de buitenste schalen.
6. Beperkte deelname van 4F orbitalen bij binding:
* De 4F -orbitalen zijn relatief begraven in de elektronenwolk en nemen minimaal deel aan chemische binding.
* Bijgevolg beïnvloedt de variatie in het aantal 4F -elektronen het algehele chemische gedrag niet significant.
Samenvattend:
De vergelijkbare elektronische configuraties, de lanthanide -contractie en de overwegend +3 oxidatietoestand dragen bij aan het vergelijkbare chemische gedrag van lanthaniden. Hun soortgelijke ionische stralen en neiging om hoge coördinatiecomplexen te vormen met minimale betrokkenheid van 4F -orbitalen bij het binden van hun gedeelde chemische eigenschappen.
 Waar komt minerale absorptie op in planten?
Waar komt minerale absorptie op in planten?  Strontium-iridiumoxide gebruikt voor maatwerk als elektronisch materiaal
Strontium-iridiumoxide gebruikt voor maatwerk als elektronisch materiaal Tutorial voor het berekenen van hoogte en temperatuur
Tutorial voor het berekenen van hoogte en temperatuur  Wat vormen ammoniumfosfaat en loodnitraat?
Wat vormen ammoniumfosfaat en loodnitraat?  Was die explosie chemisch of nucleair? Nieuw onderzoek maakt het gemakkelijker om onderscheid te maken tussen de twee
Was die explosie chemisch of nucleair? Nieuw onderzoek maakt het gemakkelijker om onderscheid te maken tussen de twee
Hoofdlijnen
- De oranje vleugels en het DNA van de kroontjeswants:hoe de diëten van insecten worden onthuld door het genoom
- Welke soort weefsel geeft de meeste tijd in interfase?
- Voor duurzame vliegtuigbrandstof ontwikkelen onderzoekers een veelbelovend micro-organisme voor de productie van precursoren
- Combineer het mysterie van hoe eencellige levensvormen zich ontwikkelden tot meercellige organismen
- Wat is een andere naam voor een eiwitketen?
- Onderzoekers vinden lage genetische diversiteit bij gedomesticeerde fretten
- Waarom wordt de cultuurbouillon voortdurend gemengd?
- In RNA a is altijd gebonden aan?
- Wanneer een gen twee of meer fenotypische eigenschappen regelt?
- Wetenschappers suggereren een milieuvriendelijke manier om zeer actieve katalysatoren te verkrijgen

- Met meer licht, scheikunde versnelt

- Het wegnemen van de knelpunten in de prestaties van lithium-zwavelbatterijen

- Kratoms befaamde pijnstillende voordelen kunnen afkomstig zijn van een van zijn metabolieten
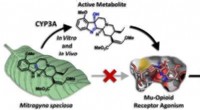
- Kristaleilanden kunnen de tijd en kosten van wetenschappelijke experimenten halveren

 Afbeelding:Plaats voor ruimtetesten
Afbeelding:Plaats voor ruimtetesten Hoeveel protonen -elektronen en neutronen hebben uranium?
Hoeveel protonen -elektronen en neutronen hebben uranium?  Wanneer geluidsgolven van lucht naar water reizen, wat gebeurt er de snelheid waarmee ze reizen?
Wanneer geluidsgolven van lucht naar water reizen, wat gebeurt er de snelheid waarmee ze reizen?  Welk enzym breekt fenylalanine af?
Welk enzym breekt fenylalanine af?  HvJ zegt dat Frankrijk Airbnb niet kan laten registreren als makelaar
HvJ zegt dat Frankrijk Airbnb niet kan laten registreren als makelaar Een klein gat door welke water en gassen uit een plant passeren?
Een klein gat door welke water en gassen uit een plant passeren?  Dieren in het gematigde regenwoud Biome
Dieren in het gematigde regenwoud Biome Wat produceert vitamine C in sinaasappels?
Wat produceert vitamine C in sinaasappels?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

