
Wetenschap
Waarom hebben chloride-ionen een 1-lading?
* de neutrale toestand van chloor: Een neutraal chlooratoom heeft 17 elektronen. De elektronenconfiguratie is 2, 8, 7. Dit betekent dat het 7 elektronen heeft in de buitenste schaal (valentieschaal).
* octetregel: Atomen hebben de neiging om elektronen te winnen of te verliezen om een stabiele configuratie te bereiken met 8 elektronen in hun valentieschil. Dit staat bekend als de Octet -regel.
* een elektron winnen: Chloor kan een stabiel octet bereiken door één elektron te winnen. Wanneer het een elektron wint, heeft het nu 18 elektronen en een 1-lading. Dit komt omdat het nog een elektron heeft dan protonen, die een positieve lading hebben.
* Vorming van chloride -ionen: Dit negatief geladen chlooratoom wordt nu een chloride-ion (Cl-) genoemd.
Samenvattend: Chloride-ionen hebben een 1-lading omdat ze één elektron hebben gewonnen om hun buitenste schaal te voltooien en een stabiele octetconfiguratie te bereiken.
 Voorspelling van sterke neerslag - het potentieel van potentiële vervorming
Voorspelling van sterke neerslag - het potentieel van potentiële vervorming Van de volgende processen in de natuur, die alleen een fysieke verandering inhoudt A. Een vogel verteert worm. B. fotosynthese vindt plaats blad. C. Een aardbeving veroorzaakt rockslide. D. brok ijzerertsroest.?
Van de volgende processen in de natuur, die alleen een fysieke verandering inhoudt A. Een vogel verteert worm. B. fotosynthese vindt plaats blad. C. Een aardbeving veroorzaakt rockslide. D. brok ijzerertsroest.?  De kloof tussen weer en klimaat overbruggen
De kloof tussen weer en klimaat overbruggen Vier soorten regen
Vier soorten regen NASA ziet tropische cycloon Sagars aan land komen
NASA ziet tropische cycloon Sagars aan land komen
Hoofdlijnen
- Wat is een fokexperiment dat ouders in één personage anders gebruikt?
- Wat is de anatomie van een orgel?
- Wat zijn de externe kenmerken van geleedpotigen?
- Voorheen onbekende dinosaurussoort geïdentificeerd in het zuidwesten van Duitsland
- Wat is transcriptie en wat zijn de belangrijkste stappen in dit proces?
- Waarom je meer sympathie zou moeten hebben voor zeemeeuwen en hoe je kunt voorkomen dat ze je fiches stelen
- Het voedsel dat wordt vervaardigd door het fotosynthese proces wordt opgeslagen als?
- Waarom komt DNA -synthese op?
- Wat in een koelkast voorkomt dat bacteriën en schimmels op het eten komen?
- Wetenschappers werpen licht op nieuw goedkoop materiaal om in het donker te zien

- Formaatdehydrogenase reduceert koolstofdioxide tot mierenzuur
- Hoe goede darmbacteriën het risico op hartaandoeningen helpen verminderen

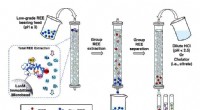
- Nieuw, milieuvriendelijke methode om zeldzame aardelementen te extraheren en te scheiden
- Een chemische aanwijzing voor hoe het leven op aarde begon

 Komt het noorderlicht voor in de troposfeer?
Komt het noorderlicht voor in de troposfeer?  Waarom kan warmte niet naar de aarde leiden?
Waarom kan warmte niet naar de aarde leiden?  Wat is een monatomische anionennaam voor F?
Wat is een monatomische anionennaam voor F?  De neurowetenschap van terrorisme:hoe we een groep radicalen overtuigden om ons hun hersenen te laten scannen
De neurowetenschap van terrorisme:hoe we een groep radicalen overtuigden om ons hun hersenen te laten scannen Met AI uitgeruste robots ontwikkelen situationeel bewustzijn in de meest onzekere omgeving van de aarde
Met AI uitgeruste robots ontwikkelen situationeel bewustzijn in de meest onzekere omgeving van de aarde Wat is de markering op een ring die platina aangeeft?
Wat is de markering op een ring die platina aangeeft?  Betekent het niet detecteren van buitenaardse wezens dat er nooit contact met ons zal worden opgenomen?
Betekent het niet detecteren van buitenaardse wezens dat er nooit contact met ons zal worden opgenomen?  Welke krachten op hete luchtballon?
Welke krachten op hete luchtballon?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

