
Wetenschap
Hoe verschillen de kationen in elk type binaire verbinding?
In ionische verbindingen zijn de kationen positief geladen ionen die worden gevormd wanneer een metaal een of meer valentie-elektronen verliest. Deze kationen hebben een netto positieve lading als gevolg van het verlies van elektronen. De lading van het kation wordt bepaald door het aantal verloren valentie-elektronen. Bijvoorbeeld:
- Na+ (natriumkation):Natrium verliest één valentie-elektron, wat resulteert in een 1+ lading.
- Mg2+ (magnesiumkation):Magnesium verliest twee valentie-elektronen, wat resulteert in een 2+ lading.
- Al3+ (aluminiumkation):Aluminium verliest drie valentie-elektronen, wat resulteert in een lading van 3+.
Covalente verbindingen:
In covalente verbindingen zijn er geen afzonderlijke kationen of anionen. In plaats daarvan delen de atomen elektronen om covalente bindingen te vormen. De elektronegativiteit van de betrokken atomen bepaalt het type en de polariteit van de covalente bindingen.
Moleculaire verbindingen:
In moleculaire verbindingen zijn de kationen doorgaans waterstofionen (H+). Deze waterstofionen zijn het resultaat van de overdracht van elektronen van een waterstofatoom naar een meer elektronegatief atoom, zoals zuurstof, stikstof of fluor. Bijvoorbeeld:
- HCl (waterstofchloride):Waterstof verliest één elektron aan chloor, wat resulteert in de vorming van H+ en Cl- ionen.
- NH4+ (ammoniumion):Stikstof haalt één elektron uit elk van de vier waterstofatomen, wat resulteert in de vorming van het NH4+-kation.
Metaalverbindingen:
Metaalverbindingen zijn samengesteld uit metaalatomen die aan elkaar zijn gebonden door metaalbindingen. In deze verbindingen delen de metaalatomen een pool van valentie-elektronen, waardoor een ‘zee’ van gedelokaliseerde elektronen ontstaat. De kationen in metaalverbindingen zijn positief geladen metaalionen, maar bestaan niet als individuele entiteiten. In plaats daarvan worden ze omringd door een zee van gedelokaliseerde elektronen.
 Hoe gebruik je perslucht?
Hoe gebruik je perslucht?  Onderzoekers maken röntgenfoto's van accu's van elektrische voertuigen terwijl ze na verloop van tijd verslechteren
Onderzoekers maken röntgenfoto's van accu's van elektrische voertuigen terwijl ze na verloop van tijd verslechteren Nieuw materiaal biedt milieuvriendelijke oplossing om restwarmte om te zetten in energie
Nieuw materiaal biedt milieuvriendelijke oplossing om restwarmte om te zetten in energie Manfred Eigen, 1967 Nobelprijswinnaar scheikunde, sterft op 91
Manfred Eigen, 1967 Nobelprijswinnaar scheikunde, sterft op 91 Onderzoekers ontwikkelen nieuwe membraanloze brandstofcel
Onderzoekers ontwikkelen nieuwe membraanloze brandstofcel
 Moet ik blijven of moet ik gaan? Onderzoekers zoeken naar manieren om de respons op orkaanevacuatieorders te voorspellen
Moet ik blijven of moet ik gaan? Onderzoekers zoeken naar manieren om de respons op orkaanevacuatieorders te voorspellen  Impact van weg en spoor op verstedelijkingsdaling
Impact van weg en spoor op verstedelijkingsdaling Het Charney-rapport:40 jaar geleden, wetenschappers hebben klimaatverandering nauwkeurig voorspeld
Het Charney-rapport:40 jaar geleden, wetenschappers hebben klimaatverandering nauwkeurig voorspeld Team geeft uiterst nauwkeurige kaart van de topografie van de Antarctische ijskap vrij
Team geeft uiterst nauwkeurige kaart van de topografie van de Antarctische ijskap vrij Wat maakt het uit? Waarom de evolutie suggereert dat de verantwoordelijkheid voor het ouderschap zelden gelijkelijk wordt gedeeld
Wat maakt het uit? Waarom de evolutie suggereert dat de verantwoordelijkheid voor het ouderschap zelden gelijkelijk wordt gedeeld
Hoofdlijnen
- Welke organellen zouden gevonden kunnen worden in een cel die zowel eukaryoot als autotroof was?
- Wat doodt de kleinste uilen van Australië?
- Onderzoeker onderzoekt de rol van kleine RNA's in communicatie tussen cellen
- Graafwespen en hun chemie
- Moeten Twitter en Facebook serieus omgaan met echte namen?
- Virtual reality blaast Afrikaanse fossielen nieuw leven in kunst en artefacten
- Heeft de jacht op trofeeën invloed op de evolutie van dikhoornschapen? Onderzoek zegt nee
- Uit nieuw onderzoek blijkt dat bioluminescentie vaker voorkomt dan eerder werd gedacht bij diepzeegarnalen
- Epigenetische inzichten:hoe hybride populier scheuten regenereert
- Weg van plastic:het geval van solid body wash

- Onderzoekers visualiseren de motor van bacteriën in de eerste stap naar door mensen geproduceerde elektrische energie
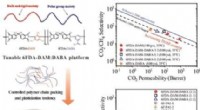
- Polyimidemembranen voor de zuivering van aardgas
- Onderzoek kan de kosten van elektronenbronnen drastisch verlagen
- lasers, levitatie en machine learning maken betere hittebestendige materialen

 LCLS:'s werelds grootste laserschrijver?
LCLS:'s werelds grootste laserschrijver?  Wetenschappers bestuderen hoe de efficiëntie van pesticiden kan worden verbeterd
Wetenschappers bestuderen hoe de efficiëntie van pesticiden kan worden verbeterd  Wanhopige race tegen branden in 's werelds grootste tropische wetlands
Wanhopige race tegen branden in 's werelds grootste tropische wetlands Studie in Ethiopië koppelt gezonde bodems aan voedzamere granen
Studie in Ethiopië koppelt gezonde bodems aan voedzamere granen Is koperdraad hetzelfde als thugstendraad?
Is koperdraad hetzelfde als thugstendraad?  Hoe Virgin Galactic werkt
Hoe Virgin Galactic werkt  Waarom er oceanen kunnen zijn in dwergplaneten voorbij Pluto – en wat dit betekent voor de waarschijnlijke overvloed aan leven
Waarom er oceanen kunnen zijn in dwergplaneten voorbij Pluto – en wat dit betekent voor de waarschijnlijke overvloed aan leven  Veiligheidsrecord Boeing 737 MAX in twijfel getrokken na twee tragedies
Veiligheidsrecord Boeing 737 MAX in twijfel getrokken na twee tragedies
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

