
Wetenschap
Waarom is het zo onoplosbaar in water?
* Sulphur's structuur: Zwavel bestaat als een vaste stof in zijn elementaire vorm. Het vormt een ringachtige structuur met acht zwavelatomen die aan elkaar zijn verbonden door sterke covalente bindingen. Deze bindingen zijn niet -polair, wat betekent dat ze geen significant verschil hebben in elektronegativiteit tussen de atomen.
* de structuur van het water: Water is een polair molecuul, wat betekent dat het een positief einde heeft (de waterstofatomen) en een negatief einde (het zuurstofatoom). Deze polariteit komt voort uit het verschil in elektronegativiteit tussen zuurstof en waterstof.
Waarom dit ertoe doet:
* "zoals oplost zoals": Het principe van "zoals oplost zoals" bepaalt dat stoffen met vergelijkbare polariteit de neiging hebben om in elkaar op te lossen.
* Polar vs. Nonpolar: Omdat zwavel niet -polair is en water polair is, zijn ze heel verschillend in termen van polariteit. Dit verschil voorkomt dat zwavel sterk genoeg interacties vormt met watermoleculen om de sterke covalente bindingen te overwinnen die zwavelatomen tegen elkaar houden.
* Zwakke interacties: Hoewel er enkele zwakke interacties (zoals van der Waals -krachten) tussen zwavel en water zijn, zijn ze niet sterk genoeg om het polariteitsverschil te overwinnen en zwavel op te lossen.
in eenvoudiger termen: Stel je voor dat je olie en water probeert te mengen. Olie, net als zwavel, is niet -polair, terwijl water polair is. Ze afstoten elkaar en je krijgt geen homogeen mengsel. Hetzelfde principe is van toepassing op zwavel en water.
 De stabiliteit van een nuclide hangt af van de?
De stabiliteit van een nuclide hangt af van de?  Hoe zijn mineralen nuttig?
Hoe zijn mineralen nuttig?  Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen
Onderzoekers ontwikkelen een efficiënte, energiezuinige methode voor het upcyclen van polyethyleen plastic afval tot waardevolle moleculen Wat is de lading van ammoniumnitraat?
Wat is de lading van ammoniumnitraat?  Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies
Verdwijningshandeling:apparaat verdwijnt op commando na militaire missies
 Smog kan FIFA U-17 World Cup uit Delhi dwingen
Smog kan FIFA U-17 World Cup uit Delhi dwingen Water, overal water... het meeste is nu veilig om te drinken in een Engels dorp na de uitbraak van de parasiet
Water, overal water... het meeste is nu veilig om te drinken in een Engels dorp na de uitbraak van de parasiet  NASA vindt tropische cycloon Flamboyan in een zuidoostelijk stuk
NASA vindt tropische cycloon Flamboyan in een zuidoostelijk stuk Calabrese zegt dat een fout heeft geleid tot het aannemen van het LNT-model in de toxicologie
Calabrese zegt dat een fout heeft geleid tot het aannemen van het LNT-model in de toxicologie Onderzoekers onderzoeken hoe burgers agenten kunnen worden van veranderingen in het milieu
Onderzoekers onderzoeken hoe burgers agenten kunnen worden van veranderingen in het milieu
Hoofdlijnen
- Het symposium in Pittsburgh antwoordt:Wat is Watson?
- Onderzoeksvraag:Wat zijn computervirussen en waar komen ze vandaan?
- Paranoia zal vernietigen:wanneer overschrijdt gezonde angst de grens in paranoia?
- Wat voor soort wetenschapper is Carolus Linnaeus?
- Kunnen honden komkommers eten? Zijn ze veilig? Hun gezondheidsvoordelen uitgelegd
- Hoe menselijk sperma echt zwemt:nieuw onderzoek daagt eeuwenoude veronderstellingen uit
- Genen die niet tot expressie worden gebracht als er een dominant gen aanwezig is opgeroepen?
- Galapagos-studie toont aan dat nieuwe soorten zich in slechts twee generaties kunnen ontwikkelen
- Wat is het proces door welk cellulair materiaal verdeeld tussen twee cellen?
- Chemici identificeren de structuur van het middel dat mutaties veroorzaakt in embryo's van koraalduivels
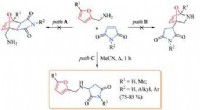
- De DNA-smeltcurve nauwkeuriger maken

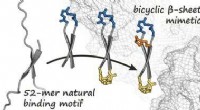
- Bicyclische eiwitmimetica remmen het oncogen β-catenine
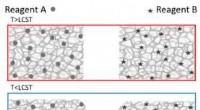
- Studie initieert chemische reacties door materialen te koelen in plaats van ze te verwarmen
- Analyseren van de voor- en nadelen van twee composietproductiemethoden

 Wat is windbrandstof?
Wat is windbrandstof?  Wilde vissen gedijen ondanks hopeloze monstermutaties, volgens onderzoek
Wilde vissen gedijen ondanks hopeloze monstermutaties, volgens onderzoek Hoe helikopters werken
Hoe helikopters werken  Wat zijn de drie zones van verhoogde aardbevingen en vulkanische eUptions?
Wat zijn de drie zones van verhoogde aardbevingen en vulkanische eUptions?  Hoe kunnen we de maan helder zien schijnen?
Hoe kunnen we de maan helder zien schijnen?  Nokia worstelt met verliezen na uitdagend kwartaal
Nokia worstelt met verliezen na uitdagend kwartaal Wat voor soort gassen zijn er in nevels?
Wat voor soort gassen zijn er in nevels?  In wat voor soort energie verandert potentieel in?
In wat voor soort energie verandert potentieel in?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

