
Wetenschap
Wat is het punt- en kruisdiagram voor carbonylchloride?
1. Bepaal de valentie -elektronen
* koolstof (c): 4 valentie -elektronen
* zuurstof (O): 6 valentie -elektronen
* chloor (CL): 7 valentie -elektronen elk (totaal van 14 voor twee chlooratomen)
2. Schik de atomen
* Koolstof is het centrale atoom omdat het het minst elektronegatief is.
* Zuurstof is dubbel gebonden aan koolstof.
* De twee chlooratomen zijn met één binding tot koolstof.
3. Teken de bindingen en eenzame paren
* Gebruik lijnen om de bindingen tussen atomen weer te geven.
* Vul de resterende valentie -elektronen in als eenzame paren rond de zuurstof- en chlooratomen.
Hier is de DOT- en Kruisdiagram:
`` `
..
:O:
||
C
/ \
:Cl ::Cl:
..
`` `
Verklaring:
* koolstof: Heeft vier valentie -elektronen, die allemaal worden gebruikt bij binding (twee met zuurstof en één met elk chloor).
* zuurstof: Heeft zes valentie -elektronen. Twee worden gebruikt in de dubbele binding met koolstof en de resterende vier zijn aanwezig als twee eenzame paren.
* chloor: Elk chloor heeft zeven valentie -elektronen. Eén wordt gebruikt in de enkele binding met koolstof en de resterende zes zijn aanwezig als drie eenzame paren.
Sleutelpunten:
* Het diagram toont de gedeelde elektronen (bindingen) als lijnen.
* Elke lijn vertegenwoordigt een gedeeld paar elektronen (één van elk bindingsatoom).
* Lone paren worden weergegeven als stippen.
* Het diagram moet voldoen aan de octetregel (behalve voor waterstof, die de duetregel volgt), wat betekent dat elk atoom (behalve waterstof) acht elektronen in zijn valentieschil moet hebben.
 Twee verschillende fysieke mechanismen geïdentificeerd voor hoe eenvoudig schuim instort
Twee verschillende fysieke mechanismen geïdentificeerd voor hoe eenvoudig schuim instort Wat is een andere stof naast Borax om een polymeerbal te maken?
Wat is een andere stof naast Borax om een polymeerbal te maken?  Wat is de chemische naam voor PDCL2?
Wat is de chemische naam voor PDCL2?  Wat is het toestandssymbool voor natriumchloride -oplossing?
Wat is het toestandssymbool voor natriumchloride -oplossing?  Wat zijn de vier elementen van de wetenschappelijke methode?
Wat zijn de vier elementen van de wetenschappelijke methode?
 Hoe een over het hoofd gezien onderzoek van meer dan een eeuw geleden de Colorado River-crisis heeft aangewakkerd
Hoe een over het hoofd gezien onderzoek van meer dan een eeuw geleden de Colorado River-crisis heeft aangewakkerd  Wat zijn het belangrijkste type middelen van de aarde?
Wat zijn het belangrijkste type middelen van de aarde?  Russen gedood bij rakettest werkten aan nieuwe wapens
Russen gedood bij rakettest werkten aan nieuwe wapens De natuur gebruiken om het klimaat te helpen:vier manieren die werken
De natuur gebruiken om het klimaat te helpen:vier manieren die werken  Biodiversiteit van zoete aardappelen kan helpen om de klimaatbestendigheid van kleinschalige landbouw te vergroten
Biodiversiteit van zoete aardappelen kan helpen om de klimaatbestendigheid van kleinschalige landbouw te vergroten
Hoofdlijnen
- Habitats zijn veel kwetsbaarder voor stikstofdepositie dan eerder werd gedacht
- Wat beschrijft nauwkeurig hoe temperatuur de enzymactiviteit beïnvloedt?
- Twee derde van de twintigers woont nu bij hun ouders. Dit is hoe dit levens beïnvloedt
- Welk effect heeft de temperatuur op cellulaire enzymactiviteit?
- Zijn de belangrijkste producten van de wetenschap labvaardigheden en gegevens?
- In het laboratorium gekweekt vlees zou de mensheid een ernstig moreel falen kunnen laten negeren
- Theorie hersteld in termen van moderne genetica wordt genoemd?
- Wat moet er waar zijn dat een hypothese door wetenschapper algemeen wordt geaccepteerd?
- Geurdetectiehonden onderscheiden geurmoleculen beter dan eerder werd gedacht
- Zonnecelmateriaal presteert beter onder druk

- Hybride elektro-biosysteem upcyclet koolstofdioxide tot energierijke verbindingen met lange ketens
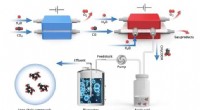
- Van het laboratorium, de eerste kraakbeen-nabootsende gel die sterk genoeg is voor knieën

- Kunstmatige intelligentie ARTIST legt direct materiaaleigenschappen vast

- Geneesmiddelgeïnduceerde celmembraancomplexen induceren de dood van kankercellen

 Wat is de vergelijking voor de reactie van butylamine met HCl?
Wat is de vergelijking voor de reactie van butylamine met HCl?  Team ontwikkelt nieuwe halfgeleiderverwerkingstechnologie
Team ontwikkelt nieuwe halfgeleiderverwerkingstechnologie Wat is een kleine dichte rotsachtige planeet vergelijkbaar met de aarde?
Wat is een kleine dichte rotsachtige planeet vergelijkbaar met de aarde?  Welke straling bombardeert ons vanuit de ruimte?
Welke straling bombardeert ons vanuit de ruimte?  Wat is de eenvoudigste definitie voor redox -reactie?
Wat is de eenvoudigste definitie voor redox -reactie?  Matrixbeeldvorming:een innovatie voor het verbeteren van de ultrasone resolutie
Matrixbeeldvorming:een innovatie voor het verbeteren van de ultrasone resolutie Welke factoren spelen een rol bij de kosten van zonnepanelen?
Welke factoren spelen een rol bij de kosten van zonnepanelen?  Wanneer verscheen de mens als de aarde een 12-uursklok is?
Wanneer verscheen de mens als de aarde een 12-uursklok is?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

