
Wetenschap
Welk type hydrogenen kan ioniseren in een verbinding?
Factoren die van invloed zijn op waterstofionisatie:
* elektronegativiteit: Hydrogenen bevestigd aan sterk elektronegatieve atomen (zoals zuurstof, stikstof en halogenen) zijn zuurder. Deze atomen trekken elektronendichtheid weg van de waterstof, waardoor het gemakkelijker is om zijn proton te verliezen.
* Hybridisatie: Hydrogenen gebonden aan SP gehybridiseerde koolstofatomen zijn zuurder dan die verbonden aan SP2 of SP3 gehybridiseerde koolstofatomen. Dit komt omdat de SP gehybridiseerde orbital een hoger S-karakter heeft, waardoor de C-H-binding meer gepolariseerd is en de waterstof waarschijnlijker is om te ioniseren.
* inductieve effecten: Elektronen-withendinggroepen (zoals halogenen) bevestigd aan een koolstofatoom kunnen de aangrenzende waterstof zuurder maken. Dit komt omdat ze de elektronendichtheid wegtrekken van de C-H-binding, het verzwakken en ionisatie vergemakkelijken.
* Resonantie -effecten: Als de conjugaatbasis gevormd na het verlies van een proton kan worden gestabiliseerd door resonantie, zal de overeenkomstige waterstof zuurder zijn.
Soorten hydrogenen die kunnen ioniseren:
* carbonzuren: De waterstof bevestigd aan de zuurstof van een carbonzuurgroep (R-COOH) is zeer zuur vanwege de resonantiestabilisatie van het carboxylaatanion.
* fenolen: De waterstof bevestigd aan de zuurstof van een fenolgroep (AR-OH) is ook zuur, hoewel minder dan in carbonzuren. Dit komt omdat de negatieve lading op het fenoxide -anion wordt gedelokaliseerd over de aromatische ring.
* alcoholen: Hoewel de waterstof bevestigd aan de zuurstof van een alcohol (R-OH) over het algemeen minder zuur is dan die in carbonzuren of fenolen, kan deze nog steeds onder bepaalde omstandigheden ioniseren, met name in aanwezigheid van een sterke basis.
* Terminal Alkynes: De waterstof bevestigd aan de terminale koolstof van een alkyn (R-C≡C-H) is relatief zuur vanwege de SP-hybridisatie van de koolstof.
* Alpha -hydrogenen: Hydrogenen bevestigd aan de koolstof grenzend aan een carbonylgroep (C =O) staan bekend als alfa -hydrogenen. Ze zijn relatief zuur vanwege het elektronen-withending-effect van de carbonylgroep.
* Andere speciale gevallen: Er zijn andere gevallen waarin hydrogenen kunnen ioniseren, vaak beïnvloed door de specifieke moleculaire structuur en omgeving. Hydrogenen in bepaalde zure omgevingen, zoals een sterk zuur, kunnen bijvoorbeeld ook ioniseren.
Belangrijke opmerking: De zuurgraad van een waterstof is een relatief concept. Er is een scala aan zuurgraad, en wat in de ene context als "zuur" wordt beschouwd, is misschien niet in een andere.
Laat het me weten als je wilt dat ik een specifiek type waterstof uitwerk of voorbeelden geef!
 Inheemse kennis sleutel tot succesvol ecosysteemherstel
Inheemse kennis sleutel tot succesvol ecosysteemherstel Negatieve effecten van Clear-Cutting
Negatieve effecten van Clear-Cutting  Weet je nog dat ze zeiden dat Miami onder water zou staan? Een voorproefje van de toekomst
Weet je nog dat ze zeiden dat Miami onder water zou staan? Een voorproefje van de toekomst  Nieuwe deeltjesvorming gevonden in sterk vervuilde lucht
Nieuwe deeltjesvorming gevonden in sterk vervuilde lucht Evacués uit Utah zagen vlammen dichterbij komen, rook wordt dikker
Evacués uit Utah zagen vlammen dichterbij komen, rook wordt dikker
Hoofdlijnen
- Niet-dodelijke parasieten verminderen de hoeveelheid die hun wilde gastheren eten, wat leidt tot ecosysteemeffecten
- Wat is het verschil in DNA tussen ouderoproep en dochtercellen?
- Waar vind je het meest waarschijnlijk het grootste aantal levende organismen?
- Wordt een plantencel beschouwd als veel cellen organisme?
- Welke bio -moleculen zitten in een ribosomen?
- Welke morfologische interferentie en voorbeelden geven?
- Goede hond of slechte hond? Nieuw onderzoek toont aan dat ras niet echt een voorspeller van gedrag is
- Britse rundvleesboeren willen overstappen naar netto nul, maar praktische en financiële belemmeringen staan in de weg
- Welke eigenschap van een virus bepaalt de gehechtheid aan het membraan van het hostcel?
- Biosensor-chip detecteert draadloos single-nucleotide polymorfisme, met hogere gevoeligheid
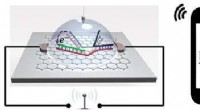
- Chemicaliën die malaria genezen, kunnen ook onkruid doden

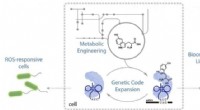
- Chemici breiden genetische code van E. coli uit om 21e aminozuur te produceren, het nieuwe vaardigheden geven
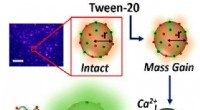
- Wetenschappers onthullen hoe wasmiddelen eigenlijk werken
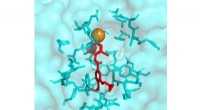
- Onderzoekers doen inspanningen om parasitaire rondwormen te bestrijden
 Wie heeft meer protonen neon of silicium?
Wie heeft meer protonen neon of silicium?  Welke golven reizen door vacuüm?
Welke golven reizen door vacuüm?  De bewoonbaarheid van Titan en zijn oceaan
De bewoonbaarheid van Titan en zijn oceaan Een verborgen bron van luchtvervuiling? Je dagelijkse huishoudelijke taken
Een verborgen bron van luchtvervuiling? Je dagelijkse huishoudelijke taken Hoeveel bomen kan een bij bestoven?
Hoeveel bomen kan een bij bestoven?  Is de volgende zin waar of onwaar wanneer massief mantelrots stijgt tijdens de verspreiding van zeebodems magma wordt geproduceerd als gevolg van het smelten van decompressie?
Is de volgende zin waar of onwaar wanneer massief mantelrots stijgt tijdens de verspreiding van zeebodems magma wordt geproduceerd als gevolg van het smelten van decompressie?  Amerikaanse Senaat stemt voor opnieuw verbod op China's ZTE, aandelen kelderen
Amerikaanse Senaat stemt voor opnieuw verbod op China's ZTE, aandelen kelderen Wat voor soort kaart toont rotstypen die het oppervlak maken?
Wat voor soort kaart toont rotstypen die het oppervlak maken?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

