
Wetenschap
Is waterstofsulfide een sterk zuur?
Dit is waarom:
* ionisatie: Hoewel H₂s een proton (H⁺) kan doneren om het hydrosulfide -ion (HS⁻) te vormen, doet dit dit slechts in een beperkte mate in oplossing.
* evenwicht: De ionisatiereactie van H₂S is een evenwichtsreactie, die voorstander is van het niet -gediscied H₂S -molecuul. Dit betekent dat de meeste H₂s -moleculen intact blijven in oplossing.
* zure dissociatieconstante (ka): De KA -waarde voor H₂s is erg klein (ongeveer 1 x 10⁻⁷), wat aangeeft dat het een zwak zuur is. Een kleinere KA -waarde betekent dat het zuur minder gemakkelijk ioniseert.
Daarentegen sterke zuren Zoals zoutzuur (HCL) volledig ioniseren in oplossing, wat betekent dat ze al hun protonen gemakkelijk doneren.
 Onderschatting van geïrrigeerde gewassen leidt tot watertekorten
Onderschatting van geïrrigeerde gewassen leidt tot watertekorten Transformatie en mechanismen van klimaat-nat/droog-verandering op het noordelijke Tibetaanse plateau onder de opwarming van de aarde
Transformatie en mechanismen van klimaat-nat/droog-verandering op het noordelijke Tibetaanse plateau onder de opwarming van de aarde  Tyfoon beschadigt gebouwen, overstroomt wegen op het Koreaanse schiereiland
Tyfoon beschadigt gebouwen, overstroomt wegen op het Koreaanse schiereiland Welk gebied van wetenschap was Wegener deskundig?
Welk gebied van wetenschap was Wegener deskundig?  Gecombineerde rivierstromen kunnen tot 3 miljard microplastics per dag de Golf van Bengalen in sturen
Gecombineerde rivierstromen kunnen tot 3 miljard microplastics per dag de Golf van Bengalen in sturen
Hoofdlijnen
- Hoe zou een celmembraan er onder krachtige microscoop uitzien?
- Uitleggen hoe de hersenen gezichten herkennen
- Wat is een enylena alsjeblieft, ik heb een antwoord nodig voor mijn examen op cellen?
- Waarom sommige grassen een efficiëntere fotosynthese ontwikkelden en andere niet
- Welk proces gebruikt de code op een RNA -molecuul om een eiwit te maken?
- Op zoek naar het CRISPR Zwitsers zakmes
- Wat voor soort lipide vormt de dubbellaag die celmembranen vormt?
- Seizoensregulatie in de biologische klok van de bonenbughersenen
- Wat is de term die het tegenovergestelde van dorsaal betekent?
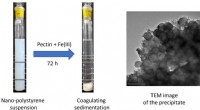
- Interactie tussen nanoplastics en pectine, een in water oplosbaar polysacharide
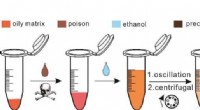
- Ethanolextractie SERS-strategie biedt zeer gevoelige detectie van vergiften in olieachtige matrix
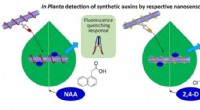
- Onderzoekers ontwerpen sensoren om plantenhormonen snel te detecteren
- Kinderen houden niet van bloemkool, broccoli kan in hun microbioom worden geschreven

- Biosensor kan binnen enkele uren een kleine aanwezigheid van salmonella in voedsel detecteren

 Welke metrische eenheid meet het volume van een object met rechte zijden?
Welke metrische eenheid meet het volume van een object met rechte zijden?  Natuurkundigen ontwikkelen schaalbare methode om grafeen te maken
Natuurkundigen ontwikkelen schaalbare methode om grafeen te maken Wat is de afdaling van de downhill massa van rotsen of grond als gevolg van de zwaartekracht?
Wat is de afdaling van de downhill massa van rotsen of grond als gevolg van de zwaartekracht?  Computersimulaties van eiwitten helpen ontrafelen waarom chemotherapieresistentie optreedt
Computersimulaties van eiwitten helpen ontrafelen waarom chemotherapieresistentie optreedt  Waarom veroorzaken evenwichtige krachten geen versnelling?
Waarom veroorzaken evenwichtige krachten geen versnelling?  Plasmaversnelling:het zit allemaal in de mix
Plasmaversnelling:het zit allemaal in de mix Hier komt de zon:een nieuw raamwerk voor kunstmatige fotosynthese
Hier komt de zon:een nieuw raamwerk voor kunstmatige fotosynthese Waarom zijn planetaria belangrijk?
Waarom zijn planetaria belangrijk?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

