
Wetenschap
Wat zijn de producten van elektrolyse waterige loodnitraat?
1. Verdunde loodnitraatoplossing:
* bij de kathode (negatieve elektrode): Waterstofgas (H₂) wordt geproduceerd door de vermindering van watermoleculen.
* bij de anode (positieve elektrode): Zuurstofgas (O₂) wordt geproduceerd vanwege de oxidatie van watermoleculen.
Reactievergelijkingen:
* kathode: 2h₂o + 2e⁻ → H₂ + 2OH⁻
* anode: 2h₂o → o₂ + 4h⁺ + 4e⁻
Algemene reactie: 2h₂o → 2h₂ + o₂
2. Geconcentreerde loodnitraatoplossing:
* bij de kathode: Leadmetaal (PB) wordt geproduceerd vanwege de reductie van loodionen (PB²⁺).
* bij de anode: Zuurstofgas (O₂) wordt geproduceerd vanwege de oxidatie van watermoleculen.
Reactievergelijkingen:
* kathode: Pb²⁺ + 2e⁻ → pb
* anode: 2h₂o → o₂ + 4h⁺ + 4e⁻
Algemene reactie: PB²⁺ + 2H₂O → PB + O₂ + 4H⁺
belangrijke opmerkingen:
* elektroden: Het gebruik van inerte elektroden zoals platina of grafiet is essentieel om zijreacties te voorkomen.
* concentratie: De concentratie van de loodnitraatoplossing bepaalt welke reactie de voorkeur heeft bij de kathode. In verdunde oplossingen is waterstofevolutie gunstiger, terwijl in geconcentreerde oplossingen de afzetting van lood de voorkeur heeft.
Samenvattend kan de elektrolyse van waterige loodnitraat produceren:
* waterstofgas (H₂) en zuurstofgas (O₂) in verdunde oplossingen.
* Loodmetaal (PB) en zuurstofgas (O₂) in geconcentreerde oplossingen.
Laat het me weten als je een meer gedetailleerde uitleg wilt van een specifiek aspect van het proces!
 Hoeveel elektronen zijn er in het 3e belangrijkste energieniveau N 3 van een fosforatoom?
Hoeveel elektronen zijn er in het 3e belangrijkste energieniveau N 3 van een fosforatoom?  Wat zijn enkele gassen met groene houding?
Wat zijn enkele gassen met groene houding?  Wordt een blauwe kreeft rood omdat deze fysische of chemische verandering kookt?
Wordt een blauwe kreeft rood omdat deze fysische of chemische verandering kookt?  Waarom is zwavel het negatieve ion in pyriet?
Waarom is zwavel het negatieve ion in pyriet?  Duizenden liters goed:LSU-chemici helpen Louisiana bij het bereiden van grote hoeveelheden handontsmettingsmiddel
Duizenden liters goed:LSU-chemici helpen Louisiana bij het bereiden van grote hoeveelheden handontsmettingsmiddel
 Hoe smaakt Australische koffie, en hoe is deze te vergelijken? Onderzoek beschrijft zijn unieke ‘terroir’
Hoe smaakt Australische koffie, en hoe is deze te vergelijken? Onderzoek beschrijft zijn unieke ‘terroir’  Het vermogen van de kwelders om koolstof af te zinken kan worden bedreigd door stikstofvervuiling
Het vermogen van de kwelders om koolstof af te zinken kan worden bedreigd door stikstofvervuiling Grotere overstromingsrisico's in de kuststreek van China door tragere tropische cycloonbeweging
Grotere overstromingsrisico's in de kuststreek van China door tragere tropische cycloonbeweging Vuilnis gedumpt in zee voor Libanon zorgt voor verontwaardiging
Vuilnis gedumpt in zee voor Libanon zorgt voor verontwaardiging Klimaatverandering beïnvloedt zowel de mentale en sociale gezondheid als het fysieke welzijn
Klimaatverandering beïnvloedt zowel de mentale en sociale gezondheid als het fysieke welzijn
Hoofdlijnen
- Hebben alle mensen een uniek genotype en fenotype?
- Vijf nieuwe malariatargets die kunnen leiden tot een effectief vaccin
- Woord voor het vermogen om te handelen of uit te voeren of aangeboren gecultiveerde capaciteit een natuurlijke functie?
- Welke soorten moleculen katalyseren RNA-splitsing?
- Wat wetenschappers weten over de glans van de juweelkever
- Hoe in een laboratorium gekweekte huid werkt
- Welke religie volgde Charles Darwin?
- Wat wetenschapscommunicatoren zouden kunnen leren van marketingprofessionals
- Kunnen mutaties die in somatische cellen voorkomen, worden doorgegeven aan een nakomelingen van een organismen?
- Programmeren met de lichtschakelaar
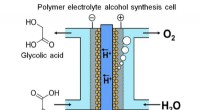
- Onderzoek naar elektrolyse voor energieopslag
- Onderzoekers bouwen robotwetenschapper die al een nieuwe katalysator heeft ontdekt

- Eiwitbatterijen produceren voor veiligere, milieuvriendelijke energieopslag

- Onderzoekers rapporteren allereerste eiwithydrogels gemaakt in levende cellen
 Inertiële opsluiting fusie-implosies hebben significante 3D-asymmetrieën
Inertiële opsluiting fusie-implosies hebben significante 3D-asymmetrieën Wie profiteert het meeste van hoogopgeleide buitenlandse werknemers?
Wie profiteert het meeste van hoogopgeleide buitenlandse werknemers?  Ondiepe sodameren zijn veelbelovend als bakermat van het leven op aarde
Ondiepe sodameren zijn veelbelovend als bakermat van het leven op aarde  Eiwitoxidatie onthult het niveau van milieuvervuiling in Doñana National Park
Eiwitoxidatie onthult het niveau van milieuvervuiling in Doñana National Park Hoe wordt terminale snelheid bereikt door een vallend object?
Hoe wordt terminale snelheid bereikt door een vallend object?  Paden in welke objecten reizen rond de zon?
Paden in welke objecten reizen rond de zon?  Als je staat als Superman of Wonder Woman, zou je je dan sterker voelen?
Als je staat als Superman of Wonder Woman, zou je je dan sterker voelen? Onderzoekers presenteren nieuwe directe detectiebeperkingen op Sub-GeV donkere materie
Onderzoekers presenteren nieuwe directe detectiebeperkingen op Sub-GeV donkere materie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

