
Wetenschap
Hoe verhouden de eigenschappen van natriumchloride zich met en chloor?
natrium (na)
* Staat bij kamertemperatuur: Zacht, zilverachtig wit metaal
* smeltpunt: 97,72 ° C (207,9 ° F)
* kookpunt: 882.9 ° C (1621.2 ° F)
* Reactiviteit: Zeer reactief, reageert gemakkelijk met water en lucht
* toxiciteit: Zeer giftig, reageert gewelddadig met waterproducerende brandbaar waterstofgas
chloor (CL)
* Staat bij kamertemperatuur: Geelachtig groen gas
* smeltpunt: -101,5 ° C (-150,7 ° F)
* kookpunt: -34.04 ° C (-29.27 ° F)
* Reactiviteit: Zeer reactief, een sterk oxidatiemiddel
* toxiciteit: Zeer giftig, een irriterend ademhalingsmiddel
Natriumchloride (NaCl)
* Staat bij kamertemperatuur: Wit, kristallijne vaste stof
* smeltpunt: 801 ° C (1474 ° F)
* kookpunt: 1465 ° C (2669 ° F)
* Reactiviteit: Relatief niet -reactief, oplosbaar in water
* toxiciteit: Niet giftig in kleine hoeveelheden (tafelzout) maar kan in grote hoeveelheden schadelijk zijn
Sleutelverschillen
* Fysieke toestand: Natrium en chloor zijn beide elementen in hun pure vorm, terwijl natriumchloride een verbinding is.
* Reactiviteit: Zowel natrium als chloor zijn zeer reactief, terwijl natriumchloride relatief niet -reactief is.
* toxiciteit: Zowel natrium als chloor zijn zeer giftig, terwijl natriumchloride niet giftig is in kleine hoeveelheden.
* uiterlijk: Natrium is een glanzend metaal, chloor is een groenachtig gas en natriumchloride is een witte vaste stof.
ionische binding:
Het belangrijkste verschil tussen natriumchloride en zijn samenstellende elementen is de vorming van een ionische binding. Natrium verliest een elektron om een positief geladen ion (Na+) te worden, terwijl chloor een elektron krijgt om een negatief geladen ion te worden (Cl-). Deze tegengestelde geladen ionen trekken elkaar aan en vormen een sterke elektrostatische binding die bekend staat als een ionische binding. Deze band is verantwoordelijk voor de stabiliteit en unieke eigenschappen van natriumchloride.
Conclusie:
De eigenschappen van natriumchloride verschillen volledig van de eigenschappen van natrium en chloor als gevolg van de vorming van een ionische binding. Deze binding verandert dramatisch de reactiviteit, toxiciteit en fysieke toestand van de resulterende verbinding.
 Hoe Acid
Hoe Acid Onderzoekers rapporteren allereerste eiwithydrogels gemaakt in levende cellen
Onderzoekers rapporteren allereerste eiwithydrogels gemaakt in levende cellen Hoe berekent u de specifieke lading van de kern?
Hoe berekent u de specifieke lading van de kern?  Wat is het bewijs voor een verschuiving in equilbrium wanneer ammoniumchloride werd toegevoegd aan stockoplossing hydroxidefenolftaleïne?
Wat is het bewijs voor een verschuiving in equilbrium wanneer ammoniumchloride werd toegevoegd aan stockoplossing hydroxidefenolftaleïne?  Wat zijn enkele chemische reacties die zich buitenshuis voordoen?
Wat zijn enkele chemische reacties die zich buitenshuis voordoen?
 Is een rozenstruik en object in beweging?
Is een rozenstruik en object in beweging?  Hoe CITES werkt en 5 soorten waar u op moet letten
Hoe CITES werkt en 5 soorten waar u op moet letten  Nieuwe cycloonvaten richting door rampen getroffen Indonesië
Nieuwe cycloonvaten richting door rampen getroffen Indonesië Welk gebied van wetenschap onderzoekt het idee over een mogelijk buitenaardse oorsprongsleven?
Welk gebied van wetenschap onderzoekt het idee over een mogelijk buitenaardse oorsprongsleven?  Studies tonen aan dat wereldwijde schattingen van het smelten van ijs conservatief zijn geweest
Studies tonen aan dat wereldwijde schattingen van het smelten van ijs conservatief zijn geweest
Hoofdlijnen
- Sommige bedreigde diersoorten kunnen niet langer in het wild overleven. Dus moeten we hun genen veranderen?
- Wat is dat een goede wetenschapper?
- De verbazingwekkende efficiëntie van het leven
- Ingenieurs ontwerpen programmeerbare RNA-vaccins:tests op muizen laten zien dat ze werken tegen ebola, griep en veel voorkomende parasieten
- Wat zijn de lange moleculen van DNA die meestal worden gevonden in paren die worden genoemd?
- Wat was de bruine klodder die zich vormde in het Stanley-laboratoriumexperiment?
- Is een eicelorgaan?
- Synthetische seks in gist belooft veiligere medicijnen voor mensen
- Wat zorgt ervoor dat ATP-synthase tijdens de productie gaat draaien?
- Nieuwe katalysatoren voor betere brandstofcellen

- Nieuwe machine learning-benadering vergemakkelijkt het zoeken naar moleculaire conformeren in complexe moleculen
- Beeldvorming met superresolutie onthult het mechanisme van GLUT1-clustering
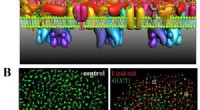
- Zelfgemaakte microscoop onthult hoe een kankerverwekkend virus zich vastklampt aan ons DNA

- Elektrische warmteklep:Strontiumkobaltoxide dunne film verandert thermische eigenschappen met aangelegde spanning
 Welke epidermale lagen bevatten Langerhans -cellen?
Welke epidermale lagen bevatten Langerhans -cellen?  Wat kunnen oceanen vormen als de atmosfeer verandert?
Wat kunnen oceanen vormen als de atmosfeer verandert?  Afkortingen van metrieksysteem
Afkortingen van metrieksysteem  Wat gebeurt er als u fluor en waterstof combineert?
Wat gebeurt er als u fluor en waterstof combineert?  Soorten wespen
Soorten wespen  Is goud chemisch gebonden of een mengsel?
Is goud chemisch gebonden of een mengsel?  De keerzijde van loyaliteit:uit onderzoek blijkt waarom sommige organisatorische doofpotaffaires ongecontroleerd blijven
De keerzijde van loyaliteit:uit onderzoek blijkt waarom sommige organisatorische doofpotaffaires ongecontroleerd blijven  Wat zijn tien verschillende krachten?
Wat zijn tien verschillende krachten?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

