
Wetenschap
Hoe breng je Zn Plus HCl --- ZnCl2 H2 in evenwicht?
1. Identificeer de reactanten en producten:
* reactanten: Zink (Zn) en zoutzuur (HCL)
* Producten: Zinkchloride (ZnCl₂) en waterstofgas (H₂)
2. Tel atomen aan elke kant:
* Zn: 1 links, 1 rechts
* h: 1 links, 2 rechts
* Cl: 1 links, 2 rechts
3. Breng de vergelijking in evenwicht:
* Balans chloor (CL): Plaats een coëfficiënt van 2 voor HCl:Zn + 2HCl → ZnCl₂ + H₂
* Balans waterstof (h): Nu is de waterstof automatisch in balans.
4. Laatste evenwichtige vergelijking:
Zn + 2HCl → ZnCl₂ + H₂
Verklaring:
Deze vergelijking vertegenwoordigt een enkele verplaatsingsreactie waarbij zink (Zn) reactiever is dan waterstof (H), dus het verplaatst waterstof uit zoutzuur (HCl) om zinkchloride (ZnCl₂) en waterstofgas (H₂) te vormen.
 Is een periode van een element de hoeveelheid tijd die nodig is voor de halve radioactieve isotoop om te vervallen?
Is een periode van een element de hoeveelheid tijd die nodig is voor de halve radioactieve isotoop om te vervallen?  Wat wordt bedoeld met reactiviteitsreeksen van metalen?
Wat wordt bedoeld met reactiviteitsreeksen van metalen?  Wat zou er met druk gebeuren als het volume gas werd gehalveerd?
Wat zou er met druk gebeuren als het volume gas werd gehalveerd?  Hoe werkt een atoomabsorptiespectrometer?
Hoe werkt een atoomabsorptiespectrometer?  Welke eenheid zou u gebruiken om de massa van een rozijnen te meten?
Welke eenheid zou u gebruiken om de massa van een rozijnen te meten?
Hoofdlijnen
- Wat is de biosfeer waarin je leeft?
- Hoe heet het orgel dat spijsverteringssappen vrijgeeft in dunne darm?
- Warme wateren in het noordwesten trekken paaiende vissen naar het noorden
- Waarom moet gedrag een genetische component hebben om te worden begunstigd door natuurlijke selectie?
- Wat is het eindproduct van eiwitten?
- Waarom zijn inunit mensen een voorbeeld van evolutie?
- Wat genereren seksuele reproductiemutatie en kruising in een populatie?
- Welke mensen zijn erg vatbaar voor ziektekiemen?
- Hoeveel organen heeft een dierencel?
- Fijne structuur onthuld van potentieel alternatief voor loodverbinding gebruikt in sensoren
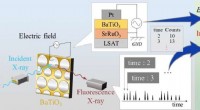
- Wetenschappers onthullen structuur van aminozuurtransporter die betrokken is bij kanker

- Eenvoudige methode om koolstofdioxide om te zetten in bruikbare verbindingen

- Implanteerbaar piëzo-elektrisch polymeer verbetert gecontroleerde afgifte van medicijnen
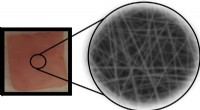
- Een manier om de structurele stabiliteit in gespannen halide perovskieten te vergroten

 Hoeveel gram ammoniumsulfaat is nodig om een 0,25 M oplossing te maken met een concentratie van 6M?
Hoeveel gram ammoniumsulfaat is nodig om een 0,25 M oplossing te maken met een concentratie van 6M?  Wie is eigenaar van de maan? Een ruimteadvocaat antwoordt
Wie is eigenaar van de maan? Een ruimteadvocaat antwoordt  Is het mogelijk om olie van water met elektriciteit te scheiden?
Is het mogelijk om olie van water met elektriciteit te scheiden?  Hoe ademen vogels beter? De ontdekking van onderzoekers zal je voor de gek houden
Hoe ademen vogels beter? De ontdekking van onderzoekers zal je voor de gek houden  Waarom stoot Sometime Plane wit gas uit in de lucht?
Waarom stoot Sometime Plane wit gas uit in de lucht?  Deze nieuwe uitvinding kan stroom opwekken uit de zachtste bries
Deze nieuwe uitvinding kan stroom opwekken uit de zachtste bries Drijvende ideeën voor een luchtsluis bij de maan
Drijvende ideeën voor een luchtsluis bij de maan Welk continent rond de Zuidpool is?
Welk continent rond de Zuidpool is?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

