
Wetenschap
Wat is een ion-dipoolbinding?
Hier is een uitsplitsing:
1. Ionen: Dit zijn atomen of groepen atomen die elektronen hebben gewonnen of verloren, wat resulteert in een netto positieve of negatieve lading.
2. Polaire moleculen: Deze moleculen hebben een permanente ongelijke verdeling van elektronendichtheid, waardoor een positief en negatief einde ontstaat (een "dipool"). Denk aan water (H₂o) met zijn zuurstofatoom met een enigszins negatieve lading en de waterstofatomen hebben een enigszins positieve lading.
3. De interactie: Het positieve uiteinde van het polaire molecuul wordt aangetrokken door het negatieve ion en vice versa. Deze attractie komt voort uit de elektrostatische krachten tussen tegengestelde ladingen.
Key -functies:
* Kracht: Ion-dipoolbindingen zijn over het algemeen sterker dan van der Waals-krachten maar zwakker dan waterstofbruggen of ionische bindingen. De sterkte hangt af van de lading van het ion en de grootte van het dipoolmoment van het polaire molecuul.
* Directionaliteit: De interactie is directioneel, wat betekent dat het ion en het polaire molecuul met elkaar moeten worden uitgelijnd voor maximale aantrekkingskracht.
* Belang: Ion-dipoolinteracties spelen een cruciale rol bij het oplossen van ionische verbindingen in polaire oplosmiddelen zoals water. Ze dragen ook bij aan de eigenschappen van veel biologische systemen, zoals de interactie van ionen met eiwitten.
Voorbeelden:
* zout (NaCl) oplossen in water: De positieve natriumionen (Na+) worden aangetrokken door het negatieve uiteinde van watermoleculen (zuurstof), terwijl de negatieve chloride-ionen (Cl-) worden aangetrokken door het positieve uiteinde van watermoleculen (waterstof). Deze interactie helpt het ionische rooster van het zout uit elkaar te breken en laat het oplossen.
* De hydratatie van ionen in oplossing: Ionen in oplossing worden omgeven door een schaal van polaire oplosmiddelmoleculen, die worden aangetrokken door de lading van de ionen door ion-dipool interacties.
Samenvattend is een ion-dipoolbinding een elektrostatische aantrekkingskracht tussen een geladen ion en een polair molecuul. Het speelt een cruciale rol in verschillende chemische en biologische processen, die de oplosbaarheid van ionische verbindingen, de hydratatie van ionen en de interacties van biomoleculen beïnvloedt.
 Nieuwe techniek om de chemische samenstelling en structuur van monsters te karakteriseren
Nieuwe techniek om de chemische samenstelling en structuur van monsters te karakteriseren Een afstembaar 2D covalent netwerk voor ladingsselectieve verwijdering van giftige kleurstoffen uit afvalwater
Een afstembaar 2D covalent netwerk voor ladingsselectieve verwijdering van giftige kleurstoffen uit afvalwater Wat is de verwijdering van mineralen die in water zijn opgelost?
Wat is de verwijdering van mineralen die in water zijn opgelost?  Waarmee wordt stikstof gecombineerd om ammoniak te maken?
Waarmee wordt stikstof gecombineerd om ammoniak te maken?  Wat is de binding tussen zuurstofatomen van gasvormige zuurstof?
Wat is de binding tussen zuurstofatomen van gasvormige zuurstof?
 Economen bagatelliseren veel grote klimaatrisico's, zegt verslag
Economen bagatelliseren veel grote klimaatrisico's, zegt verslag Wat worden observaties gemaakt met tools die worden genoemd?
Wat worden observaties gemaakt met tools die worden genoemd?  Onderzoek naar klimaatverandering wijst uit dat het seizoen van ahornsiroop eerder kan komen
Onderzoek naar klimaatverandering wijst uit dat het seizoen van ahornsiroop eerder kan komen European Hornets
European Hornets Nieuwe peiling onderzoekt de publieke opinie over wilde dieren en migratiecorridors in Wyoming
Nieuwe peiling onderzoekt de publieke opinie over wilde dieren en migratiecorridors in Wyoming
Hoofdlijnen
- 6 soorten vrij beweegbare gewrichten
- Soorten bacteriën in levensmiddelen
- Europarlementariërs dringen aan op onderzoek naar Monsantos heerschappij over veiligheidsstudies
- Waarom hebben zich zoveel nieuwe ziekten ontwikkeld in de sector salades in zakken?
- Ontdekken hoe een vleesetende schimmel wormen vangt en verteert
- Kipferl:begeleiding van de verdediging tegen springgenen
- Wat zijn de vier macromoleculen van het leven?
- Wat is een betrouwbare bron van wetenschappelijke informatie?
- Wat is de functie van een dierenspiercel in het organisme?
- Onderzoekers presenteren nieuwe strategie om de ductiliteit in een enkelfasige legering uit te breiden

- Onderzoekers ontwikkelen nieuwe behandeling voor botinfectie met koperrijk glasimplantaat

- Wetenschappers ontwikkelen een cellulose-biosensormateriaal voor geavanceerde weefseltechnologie
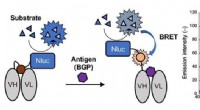
- Nieuw licht werpen:een nieuw type immunosensor voor immunoassaytests
- Stabiele moleculen reactief maken met licht

 Hoe schrijf je 6500000000 in wetenschappelijke notatie?
Hoe schrijf je 6500000000 in wetenschappelijke notatie?  Vrijwilligerswerk van medewerkers? Alleen als je denkt dat je baas ethisch is
Vrijwilligerswerk van medewerkers? Alleen als je denkt dat je baas ethisch is Stedelijke landschappen geassocieerd met gerapporteerde tevredenheid met het leven en ongelijkheden in tevredenheid met het leven op stadsniveau
Stedelijke landschappen geassocieerd met gerapporteerde tevredenheid met het leven en ongelijkheden in tevredenheid met het leven op stadsniveau Wat zijn het centrum op aarde naar buiten welke drie lagen aarde?
Wat zijn het centrum op aarde naar buiten welke drie lagen aarde?  Wat zijn de zeven grootste tektonische platen?
Wat zijn de zeven grootste tektonische platen?  De maat van de trekzwaartekracht op een object?
De maat van de trekzwaartekracht op een object?  Hoe ontstond de zon?
Hoe ontstond de zon?  Wat is het aantal atomen in H2SO4?
Wat is het aantal atomen in H2SO4?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

