
Wetenschap
Wat gebeurt er met atomen van de meeste niet -metalen als ze reageren met andere elementen?
Hier is een uitsplitsing:
* elektronegativiteit: Niet -metalen hebben een sterke aantrekkingskracht op elektronen vanwege hun relatief kleine atoomstralen en hoge nucleaire lading.
* octetregel: Niet -metalen moeten meestal een paar elektronen krijgen om een stabiele elektronenconfiguratie te bereiken met een volledige buitenste schaal (vaak acht elektronen). Dit staat bekend als de Octet -regel.
* Vorming van anionen: Door elektronen te winnen, worden niet -metalen atomen negatief geladen ionen die anionen worden genoemd.
Voorbeelden:
* chloor (CL): Een chlooratoom krijgt één elektron om een chloride -ion te worden (CL⁻).
* zuurstof (O): Een zuurstofatoom krijgt twee elektronen om een oxide -ion te worden (o²⁻).
Uitzonderingen:
* Nobele gassen: Nobele gassen hebben al een volledige buitenste schaal van elektronen, dus ze vormen over het algemeen geen ionen of reageren gemakkelijk met andere elementen.
* waterstof: Waterstof is een speciaal geval. Het kan een elektron krijgen om een hydride -ion (H⁻) te worden of een elektron verliezen om een proton te worden (H⁺).
Belangrijke opmerking: Hoewel de meeste niet -metalen elektronen krijgen, kunnen sommige ook elektronen delen in covalente bindingen, met name wanneer ze reageren met andere niet -metalen.
 Risico op meerdere klimaatomslagpunten escaleert boven 1,5°C opwarming van de aarde
Risico op meerdere klimaatomslagpunten escaleert boven 1,5°C opwarming van de aarde Ozonafbrekende chemicaliën kunnen minder tijd in de atmosfeer doorbrengen dan eerder werd gedacht
Ozonafbrekende chemicaliën kunnen minder tijd in de atmosfeer doorbrengen dan eerder werd gedacht Termieten krijgen de sfeer van wat goed smaakt
Termieten krijgen de sfeer van wat goed smaakt  3D-weergave van Amazonebossen legt de effecten van El Nino-droogte vast
3D-weergave van Amazonebossen legt de effecten van El Nino-droogte vast Wetenschappers voeren eerste in situ stralingsmetingen uit op 21 km in de lucht boven het Tibetaanse plateau
Wetenschappers voeren eerste in situ stralingsmetingen uit op 21 km in de lucht boven het Tibetaanse plateau
Hoofdlijnen
- Daar is een studie over:het stenen tijdperk had net zoveel linkse mensen
- Hoe lang duurde het om een dinosaurusei uit te broeden? Onderzoek zegt 3-6 maanden
- Verstikt, gewurgd en verdronken. Hoe plastic zakken met ballonnen zeedieren doden
- Dinosaurussen:jong, volwassen of senior?
- Welk deel van ons lichaam dient als een lever soort eenvoudige machine?
- Wat zijn de drie soorten grenzen in de wetenschap?
- Linker oog? Rechtse Amerikaanse roodborstjes hebben een voorkeur als ze naar lokeieren kijken
- Hoe helpen stambomen ons te begrijpen hoe eigenschappen worden doorgegeven?
- Panspermia:zorgden buitenaardse zaden ervoor dat het leven op aarde explodeerde?
- Een multidimensionaal beeld van SARS-CoV-2

- Een-twee-stempel katalysatoren die koolstofdioxide opvangen voor schonere brandstoffen
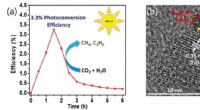
- Was de oersoep een stevige pre-eiwitstoofpot?

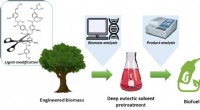
- Team ontwikkelt productieproces voor biobrandstof in samenwerking met Noord-Amerikaanse onderzoekers
- Wetenschappers bouwen chip om gezondheid van witte bloedcellen te analyseren

 Waarom zie je verschillende maanfasen?
Waarom zie je verschillende maanfasen?  Wat zijn eigenschappen van covelante verbindingen?
Wat zijn eigenschappen van covelante verbindingen?  Wat zijn de drie zwaartekrachtprincipes die het lichaam beïnvloeden?
Wat zijn de drie zwaartekrachtprincipes die het lichaam beïnvloeden?  Beschrijf een situatie waarin de auto nul snelheid heeft maar duidelijke versnelling?
Beschrijf een situatie waarin de auto nul snelheid heeft maar duidelijke versnelling?  Zou het kunnen dat religie meer op seks lijkt dan op school?
Zou het kunnen dat religie meer op seks lijkt dan op school? Het mysterie van coronale verwarming
Het mysterie van coronale verwarming Wie was de uitvinder van hygrometer?
Wie was de uitvinder van hygrometer?  Wat is een ouder mineraal?
Wat is een ouder mineraal?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

