
Wetenschap
Waarom is de standaard enthalpieverandering van neutralisatie tussen hydrofluorinezuur en natriumhydroxide negatiever dan normaal?
* HF is een zwak zuur: In tegenstelling tot sterke zuren zoals HCL, dissocieert HF niet volledig in water. Dit betekent dat sommige van de HF -moleculen niet -gedissocieerd blijven en waterstofbruggen vormen met watermoleculen.
* waterstofbinding: De waterstofbinding tussen HF en water is uitzonderlijk sterk vanwege de hoge elektronegativiteit van fluor. Deze sterke binding geeft energie af wanneer ze worden gevormd, wat bijdraagt aan een meer negatieve enthalpie -verandering.
* neutralisatie: Wanneer HF reageert met NaOH, vormt het natriumfluoride (NAF) en water. De NAF -ionen zijn volledig gedissocieerd in oplossing, maar de geproduceerde watermoleculen nemen ook deel aan waterstofbinding met de niet -gedisciede HF -moleculen.
* Algemeen effect: De sterke waterstofbinding in de uiteindelijke oplossing brengt extra energie vrij, waardoor de enthalpieverandering van neutralisatie negatief is dan typische reacties met sterke zuren en basen.
Samenvattend:
* Sterkere waterstofbruggen: HF vormt sterkere waterstofbindingen met water in vergelijking met andere zwakke zuren.
* Energie -release: Deze sterke waterstofbinding geeft extra energie af tijdens de neutralisatie, wat resulteert in een meer negatieve enthalpieverandering.
Daarom is de neutralisatiereactie tussen HF en NaOH exotherme dan verwacht voor typische zuur-base-reacties.
 Onverwachte resultaten:schade aan Puerto Ricaanse koffieplantages door orkaan Maria gevarieerd
Onverwachte resultaten:schade aan Puerto Ricaanse koffieplantages door orkaan Maria gevarieerd Steile verkeerstol in NYC zou de patstelling verminderen, vervuiling
Steile verkeerstol in NYC zou de patstelling verminderen, vervuiling Waarschuwingen uitgegeven in Frankrijk terwijl een intense hittegolf Europa omhult
Waarschuwingen uitgegeven in Frankrijk terwijl een intense hittegolf Europa omhult Inactieve oliebronnen kunnen een grote bron van methaanemissies zijn
Inactieve oliebronnen kunnen een grote bron van methaanemissies zijn Vroeg bloeiend! De beroemde kersenbloesems van Japan verschijnen onverwachts
Vroeg bloeiend! De beroemde kersenbloesems van Japan verschijnen onverwachts
Hoofdlijnen
- Hoe werkt het skelet met het ademhalingssysteem?
- Welke basen paren met elkaar tijdens transcriptie?
- Hoe reproduceert Arcella zich?
- Onderzoekers tonen aan dat de besmetting met pesticiden verder gaat dan alleen de schil van de appel
- Wat is de gevlekte rol in de voedselketen?
- Welke organismen leven in de sfeer?
- Onderzoekers ontdekken hoe een eiwit de nadelige gevolgen van waterverlies in cellen vermindert
- Welke lichaamsdelen zijn betrokken bij een bloedneus?
- Wat zijn wetenschapper die levende systemen bestudeert?
- Oog hebben voor kleuren:bedrukbare lichtsensoren

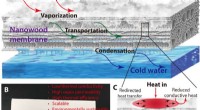
- Nieuw houten membraan biedt duurzaam alternatief voor waterfiltratie
- Slimme magnetische zachte materialen om kunstmatige spieren en therapeutische robots te ontwikkelen

- Materiaal met één elektrode stroomlijnt functies tot een kleine chip

- Techniek kan goedkopere kunstmestproductie mogelijk maken

 Welke thermische energie van Tranafers om zuigers te verplaatsen die stroom bieden?
Welke thermische energie van Tranafers om zuigers te verplaatsen die stroom bieden?  Waaruit bestaat het kleurenspectrum?
Waaruit bestaat het kleurenspectrum?  Een kracht die objecten van staal aantrekt?
Een kracht die objecten van staal aantrekt?  NASA ontdekt dat tweede tropisch systeem zich ontwikkelt in de Arabische Zee
NASA ontdekt dat tweede tropisch systeem zich ontwikkelt in de Arabische Zee Smartphonemarkt blijft dit jaar koel:voorspelling
Smartphonemarkt blijft dit jaar koel:voorspelling Hebben de dwergplaneten manen?
Hebben de dwergplaneten manen?  Wat is het maximale aantal ongepaarde elektronen in S -subshell en D P F Subshell?
Wat is het maximale aantal ongepaarde elektronen in S -subshell en D P F Subshell?  Klimaatverandering verandert de beschikbaarheid van terrestrisch water
Klimaatverandering verandert de beschikbaarheid van terrestrisch water
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

