
Wetenschap
Hoeveel mol stikstofgas zal een volume 347 ml bezetten bij 6680 Torr en 27 graden Celsius?
1. Converteren eenheden
* Volume: 347 ml =0,347 L (1 L =1000 ml)
* Druk: 6680 TORR =8.82 ATM (1 ATM =760 TORR)
* Temperatuur: 27 ° C =300 K (k =° C + 273.15)
2. Ideale gaswet
De ideale gaswet is:
PV =NRT
Waar:
* P =druk (in atm)
* V =volume (in l)
* n =aantal mol
* R =ideale gasconstante (0,0821 l · atm/mol · k)
* T =temperatuur (in k)
3. Oplossen voor n
Herschik de ideale gaswet om op te lossen voor 'n':
n =PV / RT
4. Sluit de waarden aan
n =(8,82 atm) (0,347 l) / (0,0821 l · atm / mol · k) (300 K)
5. Berekenen
n ≈ 0,124 mol
Antwoord: Ongeveer 0,124 mol stikstofgas zal dat volume onder die omstandigheden bezetten.
 Hoe Lucas Reagent te maken
Hoe Lucas Reagent te maken  Patiënten moeten het lab overslaan, krijg onmiddellijke resultaten met nieuwe bloedtesttechnologie
Patiënten moeten het lab overslaan, krijg onmiddellijke resultaten met nieuwe bloedtesttechnologie Welk type reactie treedt op wanneer zwavelzuur reageert met een alkaline?
Welk type reactie treedt op wanneer zwavelzuur reageert met een alkaline?  Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties
Wetenschappers onthullen aard van geometrische fase-effecten in ultrakoude chemische reacties Hoeveel waterstofatomen zijn er in ammoniakreinigende soulitie?
Hoeveel waterstofatomen zijn er in ammoniakreinigende soulitie?
 Een verhaal over twee soorten vulkanen
Een verhaal over twee soorten vulkanen Steden ontwerpen om natuurrampen te weerstaan
Steden ontwerpen om natuurrampen te weerstaan Congo creëert eerste beschermde mariene gebieden
Congo creëert eerste beschermde mariene gebieden Wat voor soort persoonlijke kwaliteiten doet een milieuwetenschapper?
Wat voor soort persoonlijke kwaliteiten doet een milieuwetenschapper?  Hoe hebben mensen onze planeten beïnvloed Onze planeten Biodiversiteit op zowel positieve als negatieve manieren?
Hoe hebben mensen onze planeten beïnvloed Onze planeten Biodiversiteit op zowel positieve als negatieve manieren?
Hoofdlijnen
- Carnivoren weten dat het eten van andere karkassen van carnivoren ziekten overdraagt
- Gaan we het nu echt over walvissen hebben?
- Ziet DNA er hetzelfde uit in elk organisme?
- De theorie verklaart waarom 25 procent van de culturen mannelijke geslachtsdelen afsnijdt
- Wat organiseert het genoom in de kern?
- Wat is de naam van de korte haarachtige structuur die op oppervlaktecellen wordt gevonden?
- Het ontsluiten van de genetische blauwdruk van appels:vorm- en maatkenmerken onthuld
- Bestaat er een verband tussen intelligentie en psychische aandoeningen?
- Is het malaria gerelateerd aan natuurlijke selectie?
- Hit-to-lead-onderzoeken naar een nieuwe reeks kleine molecuulremmers van DHODH

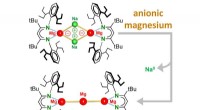
- Onderzoekers rapporteren omgekeerde magnesiumchemie-ontdekking
- Moleculaire motor:vier rotatietoestanden
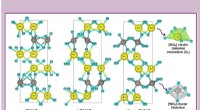
- Nieuwe generatie kooldioxidegasscheidingssysteem met adsorbentia van het gate-type

- Onderzoekers verbeteren de synthese van bismutwolframaat met een milieuvriendelijke procedure
 Aardbeving met een kracht van 6,7 op de schaal van Richter treft Filipijnen:USGS
Aardbeving met een kracht van 6,7 op de schaal van Richter treft Filipijnen:USGS Een rekbare en flexibele biobrandstofcel die draait op zweet
Een rekbare en flexibele biobrandstofcel die draait op zweet Zullen drones nieuwshelikopters vervangen?
Zullen drones nieuwshelikopters vervangen?  Is water of koolstofdioxide dichter?
Is water of koolstofdioxide dichter?  Hoe vind je de drijvende kracht en het volume ondergedompeld?
Hoe vind je de drijvende kracht en het volume ondergedompeld?  Hoeveel mol CACL2 bevatten 1,26x1024 formule -eenheden CACL2?
Hoeveel mol CACL2 bevatten 1,26x1024 formule -eenheden CACL2?  Wat gebeurt er als parallelle lichtstralen ruw of hobbelig oppervlak raken?
Wat gebeurt er als parallelle lichtstralen ruw of hobbelig oppervlak raken?  Waarom is de zon helderder dan de aarde?
Waarom is de zon helderder dan de aarde?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

