
Wetenschap
Waarom wanneer ammoniakgas in water wordt gebogen, heeft de oplossing zo'n hoge pH -waarde?
1. Ammoniak is een zwakke basis:
* Ammoniak (NH₃) is een zwakke basis. Dit betekent dat het slechts gedeeltelijk ioniseert (dissocieert) in water, waardoor een kleine hoeveelheid hydroxide -ionen (OH⁻) worden vrijgeeft.
* De chemische vergelijking voor deze reactie is:
NH₃ (aq) + h₂o (l) ⇌ nH₄⁺ (aq) + oh⁻ (aq)
2. Hydroxide -ionen verhogen pH:
* De hydroxide -ionen (OH⁻) zijn verantwoordelijk voor de alkaliteit van de oplossing (basiskarakter). Hoe hoger de concentratie van OH⁻ -ionen, hoe hoger de pH -waarde.
3. Evenwicht en beperkte ionisatie:
* Terwijl ammoniak met water reageert, is de reactie omkeerbaar. Dit betekent dat het een evenwicht bereikt waarbij sommige ammoniak niet gedissoceerd blijft en sommige worden omgezet in ammoniumionen (NH₄⁺) en hydroxide -ionen (OH⁻).
* Aangezien ammoniak een zwakke basis is, bevordert het evenwicht de niet -ongissocieerde vorm van ammoniak. Dit betekent dat de concentratie van OH⁻ -ionen relatief laag is in vergelijking met een sterke basis, maar nog steeds hoog genoeg om de pH aanzienlijk te verhogen.
Samenvattend:
* Ammoniak is een zwakke basis, wat betekent dat het slechts gedeeltelijk in water ioniseert en een beperkte hoeveelheid hydroxide -ionen vrijgeeft (OH⁻).
* De aanwezigheid van deze hydroxide -ionen verhoogt de pH van de oplossing, waardoor deze basic wordt.
* Hoe hoger de concentratie ammoniak, hoe hoger de concentratie van OH⁻ -ionen en hoe hoger de pH -waarde.
 Hoe invloedrijk is de fysieke geologie op mensen?
Hoe invloedrijk is de fysieke geologie op mensen?  Wat kan er met een boom gebeuren als deze tijdens de storm in de rivier viel?
Wat kan er met een boom gebeuren als deze tijdens de storm in de rivier viel?  Op zijn minst kan de opwarming van de aarde Amerikanen meer van de bank halen
Op zijn minst kan de opwarming van de aarde Amerikanen meer van de bank halen Hoge verwachtingen nu de nieuwe nachttrein van Oostenrijk vertrekt naar Brussel
Hoge verwachtingen nu de nieuwe nachttrein van Oostenrijk vertrekt naar Brussel Studie:hoe lessen uit de duurste drinkwatersystemen voor natuurbranden in Colorado kunnen worden toegepast
Studie:hoe lessen uit de duurste drinkwatersystemen voor natuurbranden in Colorado kunnen worden toegepast
Hoofdlijnen
- Wat zijn de componenten van nucleotiden?
- Waarom uw vruchtbaarheidscellen 'radiostilte' moeten hebben
- Wat zijn de namen van in het lichaam?
- Hebben gistcellen membraangebonden organellen?
- Hoe waar mensen zijn uitgevonden?
- Wetenschappers en boeren werken samen om Afrikaans liefdegras uit te roeien
- Waterkrachtdammen zorgen voor wijdverbreide uitsterving van soorten op de Amazone-woudeilanden
- Leg 2 manieren uit waarop technologie wordt gebruikt op het gebied van genetica?
- Contact tussen wilde vogels en kippen in de achtertuin is riskant
- Zelfherstellende composieten verlengen de levensduur van een product
- Een goedkopere manier om atomaire laagafzetting op te schalen

- Licht vangen:hoe kobalt kan helpen zichtbaar licht te gebruiken om waterstofproductie uit water aan te drijven

- Miniproteïnen die tweeledige aanvallen op virale eiwitten kunnen lanceren

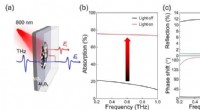
- Onderzoekers vinden breedband afstembare terahertz-absorber uit
 De pH van 0,10 M HCl -oplossing berekenen?
De pH van 0,10 M HCl -oplossing berekenen?  Hoe beïnvloeden chemicaliën het milieu?
Hoe beïnvloeden chemicaliën het milieu?  Wat is de naam van een wetenschapper die omgeving bestudeert?
Wat is de naam van een wetenschapper die omgeving bestudeert?  Intens laserlicht wijzigt de elektronenparen
Intens laserlicht wijzigt de elektronenparen Waar is de maan 's nachts?
Waar is de maan 's nachts?  Hoe je planten op de maan kweekt
Hoe je planten op de maan kweekt Wat is een functie van polyfenoloxidase in de biologie?
Wat is een functie van polyfenoloxidase in de biologie?  Hoe magneten opnieuw te magnetiseren
Hoe magneten opnieuw te magnetiseren
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

