
Wetenschap
Waarom is lithiumhydroxide en carbonaat het minst oplosbaar onder groep1 metaalhydroxidencarbonaten?
Dit is waarom:
* Oplosbaarheidstrend: Over het algemeen neemt de oplosbaarheid van groep 1 metaalhydroxiden en carbonaten toe de groep af.
* Lithium's Uitzondering: Lithium, het kleinste en meest elektronegatieve element in groep 1, vertoont enkele unieke eigenschappen.
* Roosterergie: Lithiumhydroxide en carbonaat hebben hogere rooster -energieën dan de andere groep 1 metaalhydroxiden en carbonaten. Dit komt omdat Lithium's kleine formaat en hoge ladingsdichtheid leidt tot sterkere elektrostatische attracties in het kristalrooster.
* Hydratatie -energie: Hoewel lithiumionen een hoge hydratatie -energie hebben, is het niet hoog genoeg om de sterke roosterergie te overwinnen.
Daarom zijn lithiumhydroxide en carbonaat eigenlijk meer oplosbaar dan natriumhydroxide en carbonaat, maar minder oplosbaar dan kalium-, rubidium- en cesiumhydroxiden en carbonaten. .
Samenvatting:
* Oplosbaarheidstrend: Verhoogt de groep af.
* Lithium's Uitzondering: Vanwege hoge roosterergie zijn lithiumhydroxide en carbonaat minder oplosbaar dan hun zwaardere tegenhangers.
Het is belangrijk op te merken dat hoewel lithiumhydroxide en carbonaat minder oplosbaar zijn dan de andere groep 1 -leden, ze nog steeds worden beschouwd als oplosbaar in water.
 Analyse van biologische en chemische schade aan 20e-eeuwse bouwmaterialen
Analyse van biologische en chemische schade aan 20e-eeuwse bouwmaterialen Hoe is shampoo van toepassing op de pH -schaal?
Hoe is shampoo van toepassing op de pH -schaal?  Wat kwam de eerste waterstof of promethium?
Wat kwam de eerste waterstof of promethium?  Hoe beïnvloeden de druktemperatuur en het aantal deeltjes het gedrag van een gas?
Hoe beïnvloeden de druktemperatuur en het aantal deeltjes het gedrag van een gas?  Is uw drinkwater veilig? Hier leest u hoe u daar achter kunt komen
Is uw drinkwater veilig? Hier leest u hoe u daar achter kunt komen
 Maritieme industrie zoekt oplossingen om vervuiling te beperken
Maritieme industrie zoekt oplossingen om vervuiling te beperken Milieuproblemen in gematigd bladverliezend bos?
Milieuproblemen in gematigd bladverliezend bos?  Bourgondische wijndruiven vertellen het klimaatverhaal en laten zien dat de opwarming de afgelopen dertig jaar is versneld
Bourgondische wijndruiven vertellen het klimaatverhaal en laten zien dat de opwarming de afgelopen dertig jaar is versneld  DDT in smeltwater van Alaska vormt kankerrisico voor mensen die veel vis eten
DDT in smeltwater van Alaska vormt kankerrisico voor mensen die veel vis eten Voetbalveld regenwoud vernietigd elke zes seconden
Voetbalveld regenwoud vernietigd elke zes seconden
Hoofdlijnen
- Opnieuw beoordelen wat we van peptiden kunnen verwachten bij de detectie van ziekten
- Welke functie dienen de meeste stamcellen en volwassenen?
- Opwarmende oceanen veranderen Australische populaties rifvissen
- Whodunnit, als Aussie-reptielen uitsterven:studie (update)
- Evolutie is de geleidelijke verandering in fenotypefrequentie van een soort welk proces veroorzaakt evolutie?
- "DNA Model Project Ideas
- Genetische technologie onthult hoe giftige paddenstoelen gifstoffen produceren
- Wat gorillapoep ons vertelt over evolutie en menselijke gezondheid
- Welke celorganellen worden aangetroffen in dierlijke cellen maar geen plantencellen?
- Wetenschappers zetten plastic om in bruikbare chemicaliën met behulp van zonlicht

- Groeiende actieve sites op kwantumdots voor robuuste waterstoffotogeneratie
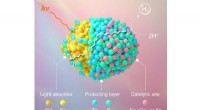
- De zich snel ontvouwende toekomst van slimme stoffen

- Een kaart van reacties helpt bij het controleren van moleculaire eigenschappen
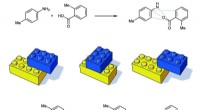
- Vloeibare kristallen die kleurveranderende inkt kunnen vervangen en valsemunterij kunnen voorkomen

 Welke materialen is geen goede isolator?
Welke materialen is geen goede isolator?  Hoe werd Minerva geboren uit Jupiters Head?
Hoe werd Minerva geboren uit Jupiters Head?  Welk sterrenbeeld is prominenter in de nachtelijke hemel:Big Dipper of Little Dipper?
Welk sterrenbeeld is prominenter in de nachtelijke hemel:Big Dipper of Little Dipper?  Hoe verschilt de regenval aan de loef- en lijzijde van een berg?
Hoe verschilt de regenval aan de loef- en lijzijde van een berg?  Investeringen in LEGO kunnen rendementen opleveren tot 600 procent
Investeringen in LEGO kunnen rendementen opleveren tot 600 procent Koolstof vertoont kwantumeffecten
Koolstof vertoont kwantumeffecten Wat is de kristalstructuur van Jadeite?
Wat is de kristalstructuur van Jadeite?  Make-up en wetenschap Eerlijke ideeën
Make-up en wetenschap Eerlijke ideeën
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

