
Wetenschap
Waarom is zwavel een slechte geleider van elektriciteit?
* Atomische structuur: Zwavelatomen hebben een sterke greep op hun elektronen, met name de valentie -elektronen. Dit komt omdat zwavel zes valentie -elektronen heeft en er nog twee nodig hebben om een stabiele octetconfiguratie te bereiken.
* Covalente binding: Zwavel vormt covalente bindingen met andere zwavelatomen, waardoor een groot, stabiel molecuul ontstaat. In covalente bindingen worden elektronen gedeeld tussen atomen, niet vrij bewegen.
* Geen gratis elektronen: Als gevolg hiervan heeft zwavel niet veel vrije elektronen die een elektrische stroom kunnen vervoeren. De elektronen zijn strak gebonden binnen de covalente bindingen.
Contrast met geleiders:
Metalen, die goede geleiders zijn, hebben losjes gebonden elektronen die gemakkelijk door het materiaal kunnen bewegen wanneer een elektrisch potentieel wordt toegepast. Dit vrije verkeer van elektronen zorgt voor de efficiënte stroom van elektriciteit.
Samenvattend: De sterke covalente bindingen van Sulphur en het gebrek aan vrije elektronen maken het een slechte geleider van elektriciteit.
Hoofdlijnen
- Waarom hebben de cellen in verschillende lichaamsweefsels functies?
- Welke cellulaire organel wordt omgeven door een dubbel membraan bevat DNA en verantwoordelijk voor het omzetten van anorganische verbindingen in organisch met behulp van lichte energie?
- Waarom zijn Archaea en verschillende domein van bacteriën?
- Wat zijn de overeenkomsten en verschillen in wetenschapstakken?
- Hoe wordt in wetenschappelijk onderzoek een mogelijke verklaring genoemd?
- Wat zijn de belangrijke bijdragen van Francesco Redi aan de biologie?
- Wat zijn de velden van biotechnologie?
- Wat is de studie van cellen afgeworpen van het epitheeloppervlak?
- Op welke basis bindt adenine in RNA?
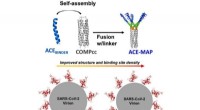
- Ontwikkeld multivalent zelf-geassembleerd bindereiwit tegen SARS-CoV-2 RBD
- Duurzame nylonproductie mogelijk gemaakt door ontdekking van bacteriën

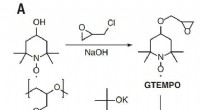
- Onderzoekers demonstreren de hoogste gerapporteerde geleidbaarheid voor organisch radicaalpolymeer
- Magnetische tanden onthuld met behulp van kwantumbeeldvorming

- Het pad naar de zuurgraad van wijnen ontdekken

 Wat is het structurele en functie -kenmerk van diafyse?
Wat is het structurele en functie -kenmerk van diafyse?  Welke energieconversies komen voor in een generator?
Welke energieconversies komen voor in een generator?  De beginconcentraties berekenen
De beginconcentraties berekenen  Hoe zal de aanpak van klimaatverandering de arbeidsmarkt beïnvloeden?
Hoe zal de aanpak van klimaatverandering de arbeidsmarkt beïnvloeden? Britse top 1 procent ontving een zesde van het inkomen van de natie vóór de crisis als gevolg van verborgen stijging van meerwaarden
Britse top 1 procent ontving een zesde van het inkomen van de natie vóór de crisis als gevolg van verborgen stijging van meerwaarden Wat zijn de 2 belangrijkste vormen van mechanische energie?
Wat zijn de 2 belangrijkste vormen van mechanische energie?  Hoe multipliers berekenen met MPC
Hoe multipliers berekenen met MPC  Het Australische Great Barrier Reef heeft moeite om te overleven
Het Australische Great Barrier Reef heeft moeite om te overleven
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com


