
Wetenschap
Als de temperatuur van een chemische reactie een verhoogde snelheid is?
* Verhoogde kinetische energie: Hogere temperatuur betekent dat moleculen meer kinetische energie hebben, sneller bewegen en vaker botsen.
* Meer succesvolle botsingen: Verhoogde botsingen leiden tot frequentere en energetische interacties tussen reactantmoleculen. Dit verhoogt op zijn beurt de kans op succesvolle botsingen die de activeringsenergiebarrière overwinnen, wat leidt tot productvorming.
* Activeringsenergie: De activeringsenergie is de minimale energie die nodig is om een reactie te laten optreden. Verhoogde temperatuur biedt meer moleculen met de energie om deze barrière te overwinnen.
Belangrijke overwegingen:
* Reactietype: Het effect van temperatuur varieert enigszins voor verschillende soorten reacties. Sommige reacties kunnen bijvoorbeeld gevoeliger zijn voor temperatuurveranderingen dan andere.
* evenwicht: Hoewel de toenemende temperatuur in het algemeen de reactiesnelheid verhoogt, kan het ook de evenwichtspositie van een omkeerbare reactie verschuiven.
Samenvattend: Hogere temperaturen leiden typisch tot snellere chemische reacties als gevolg van verhoogde moleculaire botsingen, hogere energie en een groter aantal moleculen die de activeringsenergiebarrière overwinnen.
 Can2 Wat is het oxidatienummer van N?
Can2 Wat is het oxidatienummer van N?  Is het mengen van een drankje in water fysiek of chemisch?
Is het mengen van een drankje in water fysiek of chemisch?  Onderzoekers triggeren enzymen met licht
Onderzoekers triggeren enzymen met licht Als je naar een chemische reactie kijkt, hoe weet je dan waar de reactanten en producten zich bevinden?
Als je naar een chemische reactie kijkt, hoe weet je dan waar de reactanten en producten zich bevinden?  Wat is een andere hypothese over de samenstelling en structuur van neutronenprotonelektron?
Wat is een andere hypothese over de samenstelling en structuur van neutronenprotonelektron?
 Methoden voor opgeslagen energie (anders dan oplaadbare batterijen)
Methoden voor opgeslagen energie (anders dan oplaadbare batterijen)  Van broeinest van misdaad tot joggersparadijs:het bos van Nairobi gedijt
Van broeinest van misdaad tot joggersparadijs:het bos van Nairobi gedijt Onderzoekers bereiken verbeterde voorspelling van het begin van de Indiase moesson met behulp van machine learning
Onderzoekers bereiken verbeterde voorspelling van het begin van de Indiase moesson met behulp van machine learning Ouderdom uitstellen op de Noorse plank
Ouderdom uitstellen op de Noorse plank Menselijk gedrag moet worden meegenomen in analyses van klimaatverandering
Menselijk gedrag moet worden meegenomen in analyses van klimaatverandering
Hoofdlijnen
- Welke uitspraken zijn waar voor alle wetenschappelijke inspanningen?
- Waarom hebben de meeste mensen 23 paar chromosomen?
- Laten video's de ivoorsnavelspecht zien, of is deze uitgestorven?
- Wat zijn reactanten en producten van de fructose-plus-glucose-is-sucrose-reactie?
- Wat is de vergoeding van natuurlijke hulpbronnen?
- Weten waar honden graag naar kijken, kan dierenartsen helpen hun gezichtsvermogen te beoordelen
- Wat voor soort Allele slaat een generatie over?
- Hondenurine om bedreigde bonte plevieren te redden
- Wordt politieke oriëntatie genetisch overgedragen?
- Nieuw algoritme helpt vergeten figuren onder Da Vinci-schilderij te ontdekken

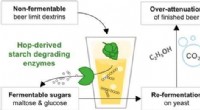
- Hoppig bier zonder ontploffende flessen en te veel alcohol
- Plastic web printen om de gsm-schermen van de toekomst te beschermen

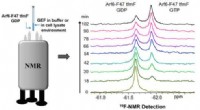
- Snelle methode helpt bij het detecteren van Arf6-guanine-nucleotide-uitwisselingsfactoractiviteit
- Metalen stimuleren een veelbelovende methode om schadelijke kooldioxide onder de zee te begraven

 Welk type energietransformatie heeft een zeilboot?
Welk type energietransformatie heeft een zeilboot?  Wat zijn enkele niet-natuurlijke bronnen?
Wat zijn enkele niet-natuurlijke bronnen?  Wat zijn vijf voorbeelden van wetenschappelijke wetgeving?
Wat zijn vijf voorbeelden van wetenschappelijke wetgeving?  Enkele foton light emitting diodes voor integratie op de chip
Enkele foton light emitting diodes voor integratie op de chip Wat is het vriespunt van een oplossing die 0,550 mol NAL in 615 g water bevat?
Wat is het vriespunt van een oplossing die 0,550 mol NAL in 615 g water bevat?  Wat betekent het woord chemische reactie?
Wat betekent het woord chemische reactie?  Welke term beschrijft de koeling van een gas door uitbreiding?
Welke term beschrijft de koeling van een gas door uitbreiding?  Hoe beïnvloedt uw afstand tot planten de zwaartekracht?
Hoe beïnvloedt uw afstand tot planten de zwaartekracht?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

