
Wetenschap
Hoeveel eenzame paar elektronen persent in een molecuul ammoniak?
Ammoniak (NH₃) heeft één Alleen al elektronen op het stikstofatoom.
Dit is waarom:
* Valentie -elektronen van stikstof: Stikstof heeft 5 valentie -elektronen.
* bindt met waterstof: In ammoniak vormt stikstof drie enkele bindingen met drie waterstofatomen. Elke binding omvat het delen van één elektron uit stikstof en één van waterstof.
* resterende elektronen: Dit laat twee van de valentie -elektronen van stikstof onbepaald. Deze twee elektronen vormen een eenzaam paar.
U kunt dit visualiseren met een Lewis -structuur:
H
|
H - n - h
|
H
De twee stippen op de stikstof vertegenwoordigen het enige paar.
 Wat is het oplosmiddel en de opgeloste stof van vuil?
Wat is het oplosmiddel en de opgeloste stof van vuil?  Dansende 'adatomen' helpen scheikundigen te begrijpen hoe watermoleculen splitsen
Dansende 'adatomen' helpen scheikundigen te begrijpen hoe watermoleculen splitsen  Welke van de volgende maatregelen Straling gegeven door atomen per seconde?
Welke van de volgende maatregelen Straling gegeven door atomen per seconde?  Science Fair-project met Cupcakes
Science Fair-project met Cupcakes Welk blok in het periodiek systeem der elementen heeft de neiging om Type II ionische verbindingen te vormen?
Welk blok in het periodiek systeem der elementen heeft de neiging om Type II ionische verbindingen te vormen?
 Hoe kwam Darwin tot zijn conclusie?
Hoe kwam Darwin tot zijn conclusie?  Geowetenschappers houden vol dat weersvoorspellingen nauwkeuriger zijn dan ooit en nog beter kunnen worden
Geowetenschappers houden vol dat weersvoorspellingen nauwkeuriger zijn dan ooit en nog beter kunnen worden Leg uit wat wordt bedoeld met een natuurlijke hulpbron?
Leg uit wat wordt bedoeld met een natuurlijke hulpbron?  Opwarming van het klimaat intensiveert de zomerdroogte in delen van de VS, studie vondsten
Opwarming van het klimaat intensiveert de zomerdroogte in delen van de VS, studie vondsten Cassave draagtassen:Indonesische ondernemer pakt plastic plaag aan
Cassave draagtassen:Indonesische ondernemer pakt plastic plaag aan
Hoofdlijnen
- Nieuwe studie onthult hoe menselijk embryo de voorloper van bloedvormende stamcellen ontwikkelt
- Wie was de eerste die vormen van bacteriën beschreef?
- Wat zijn de verschillen tussen een centraal zenuwstelsel en een centraal zenuwstelsel?
- Welke zoogdieren overwinteren?
- Welk type plantencel is ongedifferentieerd?
- Indringende vraag:Waarom overleefden zoogdieren het 'K/T-uitsterven'?
- Wat zijn 4 natuurlijke bacteriemoordenaars?
- Wat is de naam van regulerend eiwit?
- Stille code van nucleotiden, geen aminozuren, bepaalt functies van vitale eiwitten
- Verbetering van condensatie:op weg naar praktische energie- en watertoepassingen

- Levenscyclusanalyse lokaliseert duurzaamheidshotspots in biochemische productie

- Met bacteriën gecoate nanovezelelektroden verteren verontreinigende stoffen

- Polymeren die kameleonhuid nabootsen
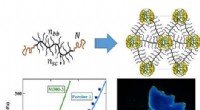
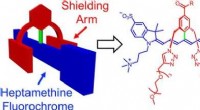
- Stabiele en functionele kleurstoffen voor nabij-infrarood fluorescentiebeeldvorming van levende onderwerpen
 In vergelijking met Crust Inner Core wordt aangenomen wat?
In vergelijking met Crust Inner Core wordt aangenomen wat?  NASA kijkt naar tropische storm Nalgae die onderhandelt over windschering
NASA kijkt naar tropische storm Nalgae die onderhandelt over windschering Nutsvoorzieningen, je kunt klei 3D printen, koekjesdeeg – of vaste raketbrandstof
Nutsvoorzieningen, je kunt klei 3D printen, koekjesdeeg – of vaste raketbrandstof Onderzoekers ontwikkelen 's werelds kleinste ultrasone detector
Onderzoekers ontwikkelen 's werelds kleinste ultrasone detector Hoe smaakte Romeinse wijn? Veel beter dan eerder werd gedacht, zo blijkt uit nieuw onderzoek
Hoe smaakte Romeinse wijn? Veel beter dan eerder werd gedacht, zo blijkt uit nieuw onderzoek  Grafeen verandert elastische eigenschappen afhankelijk van de uitgeoefende kracht
Grafeen verandert elastische eigenschappen afhankelijk van de uitgeoefende kracht Zonnecellen zien groeien
Zonnecellen zien groeien Wat levert koper II -chloride plus natriumfosfaatopbrengst op?
Wat levert koper II -chloride plus natriumfosfaatopbrengst op?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

