
Wetenschap
Wat is de volledige ionische vergelijking voor loodnitraat en kaliumsulfaat?
1. Schrijf de gebalanceerde moleculaire vergelijking:
Pb (no₃) ₂ (aq) + k₂so₄ (aq) → pbso₄ (s) + 2Kno₃ (aq)
2. Identificeer de oplosbare ionische verbindingen:
* Lood nitraat (PB (No₃) ₂) is oplosbaar in water.
* Kaliumsulfaat (k₂so₄) is oplosbaar in water.
* Kaliumnitraat (kno₃) is oplosbaar in water.
* Loodsulfaat (PBSO₄) is onoplosbaar in water.
3. Scheid de oplosbare ionische verbindingen in hun ionen:
* Pb (no₃) ₂ (aq) → pb²⁺ (aq) + 2no₃⁻ (aq)
* K₂so₄ (aq) → 2k⁺ (aq) + so₄²⁻ (aq)
* 2Kno₃ (aq) → 2k⁺ (aq) + 2no₃⁻ (aq)
4. Schrijf de volledige ionische vergelijking:
Pb²⁺ (aq) + 2no₃⁻ (aq) + 2k⁺ (aq) + so₄²⁻ (aq) → pbso₄ (s) + 2k⁺ (aq) + 2no₃⁻ (aq)
Belangrijke opmerking: Het vaste product (PBSO₄) blijft als een enkele eenheid in de vergelijking omdat het niet dissocieert in ionen in oplossing.
 Hoeveel waterstofatomen zijn er in de formule voor ammoniumsulfide?
Hoeveel waterstofatomen zijn er in de formule voor ammoniumsulfide?  Een ionische verbinding wordt niet weergegeven door een molecuulformule, omdat een verbinding?
Een ionische verbinding wordt niet weergegeven door een molecuulformule, omdat een verbinding?  Wat is een huishoudelijke ammoniakstof of -mengsel?
Wat is een huishoudelijke ammoniakstof of -mengsel?  Hoe Molaire massa te berekenen
Hoe Molaire massa te berekenen  Gevonden:een nauwkeurige methode om te bepalen hoe golven en deeltjes fusiereacties beïnvloeden
Gevonden:een nauwkeurige methode om te bepalen hoe golven en deeltjes fusiereacties beïnvloeden
 Afbeelding:Californië in vlammen
Afbeelding:Californië in vlammen Super Typhoon Noru-vaten richting Filipijnen
Super Typhoon Noru-vaten richting Filipijnen Wat zijn deze blauwe wezens die aanspoelen op de stranden van Zuid-Californië?
Wat zijn deze blauwe wezens die aanspoelen op de stranden van Zuid-Californië?  Subglaciale valleien en bergketens ontdekt in de buurt van Zuidpool
Subglaciale valleien en bergketens ontdekt in de buurt van Zuidpool Zal de Lake Erie-strategie van Ohio werken? Antwoorden zullen niet snel komen
Zal de Lake Erie-strategie van Ohio werken? Antwoorden zullen niet snel komen
Hoofdlijnen
- Waar komt ureum voornamelijk geconcentreerd?
- Hoe drie biosfeerreservaten samenkwamen om de problemen van natuurbehoud effectief op te lossen
- Is natuurlijke selectie verantwoordelijk voor geërfde eigenschappen?
- Wat scheidt fibroblasten af?
- Gedachtenexperiment:wat is ons transhumane pad voorbij de aarde?
- Welk orgaan produceert enzymen die vetten en koolhydraten afbreken?
- Zijn mensen zonder verstandskiezen hoger ontwikkeld?
- Waarom eukaryoten, en niet bacteriën, een complexe meercelligheid ontwikkelden
- Genetische studie van onsterfelijke kwallen kan de levensduur helpen verklaren
- Geen superbugs meer? Ahornsiroopextract verbetert de antibiotische werking
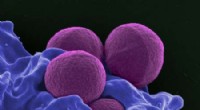
- Lasertechnieken en fotochemie vinden ongrijpbare moleculaire bouwsteen
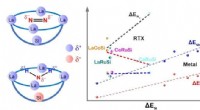
- Een komvormig gestructureerd ontwerp van een actieve site gebruiken om de schaalrelaties voor de omzetting van stikstof naar ammoniak te doorbreken
- Water ruilen voor CO2 kan fracken groener en effectiever maken

- Veilig printen met onzichtbare inkt op waterbasis

 Panama kent een brugproject van $ 1,4 miljard toe aan Chinese groep
Panama kent een brugproject van $ 1,4 miljard toe aan Chinese groep Wat wordt water vastgehouden in poriën van rotsen?
Wat wordt water vastgehouden in poriën van rotsen?  Hoe leidt glas geleid?
Hoe leidt glas geleid?  Eerste wereldwijde pact ter ondersteuning van inheemse landrechten gelanceerd
Eerste wereldwijde pact ter ondersteuning van inheemse landrechten gelanceerd Uit gegevens blijkt dat de luchtvervuiling in het noordoosten van de VS met 30 procent is afgenomen.
Uit gegevens blijkt dat de luchtvervuiling in het noordoosten van de VS met 30 procent is afgenomen. Is Gneiss een kalksteen of zandsteen?
Is Gneiss een kalksteen of zandsteen?  VS breidt onderzoek naar airbagstoringen uit naar 12,3 miljoen voertuigen
VS breidt onderzoek naar airbagstoringen uit naar 12,3 miljoen voertuigen Is er iemand op de maan gegaan?
Is er iemand op de maan gegaan?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

