
Wetenschap
Waarom zijn oxidatie- en reductieprocessen complementair?
* elektronenoverdracht: De fundamentele basis van oxidatie en reductie is de overdracht van elektronen.
* oxidatie: Een stof verliest elektronen (wordt positiever).
* reductie: Een stof wint elektronen (wordt negatiever).
* Laadbehoud: Aangezien elektronen fundamentele deeltjes zijn met een negatieve lading, moet de totale lading in een systeem evenwichtig blijven. Als het ene atoom of molecuul elektronen verliest (oxidatie), moet een ander die elektronen krijgen (reductie).
* Redox -reacties: De gelijktijdige overdracht van elektronen staat bekend als een redox -reactie . Deze reacties zijn essentieel voor veel biologische en chemische processen, waaronder:
* Cellulaire ademhaling: Het proces van het afbreken van voedsel om energie te produceren omvat de overdracht van elektronen.
* fotosynthese: Planten gebruiken zonlicht om koolstofdioxide en water om te zetten in glucose, waarbij elektronenoverdracht inhoudt.
* Corrosie: Het roest van ijzer is een redox -reactie.
* verbranding: Het verbranden van brandstof is een redox -reactie.
Voorbeeld:
Overweeg de eenvoudige reactie van magnesiummetaal met zoutzuur:
* mg (s) + 2HCl (aq) → mgcl2 (aq) + h2 (g)
In deze reactie:
* magnesium (mg) wordt geoxideerd:het verliest twee elektronen om mg²⁺ te worden.
* waterstof (h) wordt verminderd:het krijgt een elektron om H₂ te worden.
Het verlies van elektronen door magnesium wordt precies in evenwicht gebracht door de versterking van elektronen door waterstof. Dit is de reden waarom oxidatie en reductie altijd zijn gekoppeld.
In wezen zijn oxidatie en reductie twee kanten van dezelfde munt. De een kan niet optreden zonder de andere, om het behoud van lading te waarborgen en een breed scala aan chemische reacties te besturen.
 Dageraad van organische eenkristalelektronica
Dageraad van organische eenkristalelektronica Hoeveel mol Bariumnitraat BaNO3 bevat 6,80X10 tot de 24 formule-eenheden?
Hoeveel mol Bariumnitraat BaNO3 bevat 6,80X10 tot de 24 formule-eenheden?  Behoren alle atomen met hetzelfde aantal protonen tot hetzelfde element?
Behoren alle atomen met hetzelfde aantal protonen tot hetzelfde element?  Hoeveel moleculen van H2O is gelijk aan 1 mol H2O?
Hoeveel moleculen van H2O is gelijk aan 1 mol H2O?  Ion die combineert met waterstofionen om water te geven?
Ion die combineert met waterstofionen om water te geven?
Hoofdlijnen
- Studie werpt licht op het touwtrekken van kankercellen
- Wetenschappers krijgen een nieuw inzicht in het herstelproces van nucleotide-excisie
- Hoe verkrijgen pelecypods voedsel?
- Eerste structurele inzichten in hoe immuunreceptoren van planten op elkaar inwerken
- Welke planten maken medicijnen?
- Wat is cryptobiose?
- Wat zijn enkele vragen die wetenschap beantwoordt?
- Wat is het verschil tussen reproduceren en repliceren?
- Onderzoekers onthullen hoe stamcellen beslissingen nemen
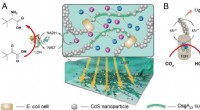
- Bacteriële biofilms vergemakkelijken biocompatibele bio-abiotische interfaces voor semi-kunstmatige fotosynthese
- Hoe groot is een fragment?

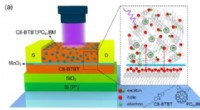
- Wetenschappers ontwikkelen ultragevoelige organische fototransistoren op basis van nieuwe hybride gelaagde architectuur
- 3D-printen van zetmeel voor gepersonaliseerde medicijnontwikkeling

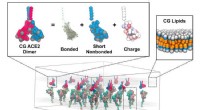
- Supercomputersimulaties onthullen de details van coronavirusfusie
 Beschrijf 2 voorwaarden op aarde die de planeet gunstig maken voor het leven?
Beschrijf 2 voorwaarden op aarde die de planeet gunstig maken voor het leven?  Biokatalyse:nieuwe methode om katalytisch actieve enzymen aan te drijven
Biokatalyse:nieuwe methode om katalytisch actieve enzymen aan te drijven Jongen of meisje? Maki-geuren hebben het antwoord
Jongen of meisje? Maki-geuren hebben het antwoord  Wat bepaalt de amplitude van een geluidsgolf?
Wat bepaalt de amplitude van een geluidsgolf?  Hoe willekeurige aanpassingen in de timing kunnen leiden tot nieuwe speltheoretische strategieën
Hoe willekeurige aanpassingen in de timing kunnen leiden tot nieuwe speltheoretische strategieën  Chinas Didi voert uitdaging voor Uber op met push in Australië
Chinas Didi voert uitdaging voor Uber op met push in Australië Bacteriële overleving in zoute antivries verhoogt de hoop op leven op Mars en ijzige manen
Bacteriële overleving in zoute antivries verhoogt de hoop op leven op Mars en ijzige manen Hoeveel huishoudelijk werk creëert een echtgenoot precies?
Hoeveel huishoudelijk werk creëert een echtgenoot precies?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

