
Wetenschap
Hoe maakt natriumchloride de watertemperatuur kouder?
Dit is waarom:
* Oplossen is een exotherme proces: Wanneer zout oplost in water, brengt het een kleine hoeveelheid warmte in het omliggende water af. Dit komt omdat de energie die nodig is om de zoutkristallen (endotherme proces) uit elkaar te breken iets minder is dan de energie die vrijkomt wanneer de zoutionen interageren met de watermoleculen (exotherme proces).
* De temperatuurverandering is te verwaarlozen: De warmte die vrijkomt tijdens het oplossen van zout is erg klein en de totale temperatuurverandering is meestal niet merkbaar.
* Het effect van zout op het vriespunt: Zout verlaagt het vriespunt van water, waardoor het moeilijker is om water te bevriezen. Daarom wordt zout in de winter op wegen en trottoirs gebruikt. Dit is echter niet hetzelfde als het water kouder maken.
Samenvattend: Het oplossen van zout in water geeft een kleine hoeveelheid warmte vrij, wat een lichte temperatuurstijging veroorzaakt. Terwijl zout het vriespunt van water verlaagt, maakt het het water zelf niet kouder.
 Hoe heet Indias Rainforest?
Hoe heet Indias Rainforest?  COVID-19-lockdowns hebben tienduizenden voortijdige sterfgevallen als gevolg van luchtvervuiling afgewend
COVID-19-lockdowns hebben tienduizenden voortijdige sterfgevallen als gevolg van luchtvervuiling afgewend Onderwerpen voor spreken in het openbaar voor tieners
Onderwerpen voor spreken in het openbaar voor tieners  Minder vlees, meer keuze - een blik op de belangrijkste voedselproblemen in 2018
Minder vlees, meer keuze - een blik op de belangrijkste voedselproblemen in 2018 Hier zijn 5 praktische manieren waarop bomen ons kunnen helpen de klimaatverandering te overleven
Hier zijn 5 praktische manieren waarop bomen ons kunnen helpen de klimaatverandering te overleven
Hoofdlijnen
- Welke organisims gebruiken binaire splijting om zich te voortplanten?
- Kan zeewier gasachtige koeien op melkveebedrijven verlichten?
- Wat zijn interleukines?
- Wordt de rivierkreeft als een gewervelde of niet -dier beschouwd?
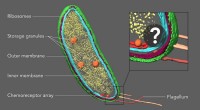
- Hoe gebruiken plantencellen flagella?
- Wat kan het effect zijn van het erven van meer dan normaal aantal chromosomen bij een mens?
- Zijn eicellen bij ouder wordende primaten beschermd tegen mutaties?
- Wat is een afgeleide UNTIT?
- Wat zijn enkele kenmerken van proteïne?
- Wetenschappers ontdekken een nieuw complex europiumhydride

- Nieuwe koolwaterstofbrandstofcellen met hoog rendement en lage kosten
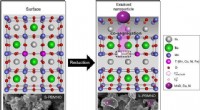
- Het testen van de mogelijkheid om nikkelhoudende katalysatoren te gebruiken om multi-koolstofproducten te produceren
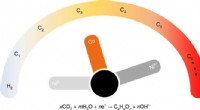
- Nieuwe techniek lokaliseert locaties van individuele moleculen in hun cellulaire buurten
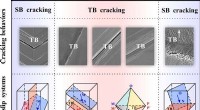
- Kunnen tweelinggrenzen bestand zijn tegen vermoeiingsscheuren?
 Waarom de opwarming van het land verschillende zee?
Waarom de opwarming van het land verschillende zee?  Bronnen van kinetische energie
Bronnen van kinetische energie Wat vertellen wetenschappers ons over het tijdperk van het universum en de planeet?
Wat vertellen wetenschappers ons over het tijdperk van het universum en de planeet?  Welke proceswijzigingen voegt informatie toe of verwijdert informatie uit het genoom?
Welke proceswijzigingen voegt informatie toe of verwijdert informatie uit het genoom?  Amoeba vindt benaderende oplossingen voor NP-hard probleem in lineaire tijd
Amoeba vindt benaderende oplossingen voor NP-hard probleem in lineaire tijd Hoe zijn de planeten hetzelfde en verschillend?
Hoe zijn de planeten hetzelfde en verschillend?  Hoe warmteopname berekenen
Hoe warmteopname berekenen
In het dagelijks leven gebruiken mensen de termen warmte en temperatuur onderling uitwisselbaar. Op het gebied van thermodynamica en fysica, echter, hebben de twee termen heel verschillende betekenissen. Als u wilt bereke
 Hoe vulkanen de aardkorst recyclen om zeldzame metalen bloot te leggen die essentieel zijn voor groene technologie
Hoe vulkanen de aardkorst recyclen om zeldzame metalen bloot te leggen die essentieel zijn voor groene technologie
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

