
Wetenschap
Wat is de Lewis -structuur voor fosfor pentabromide?
1. Tel valentie -elektronen:
- Fosfor (P) heeft 5 valentie -elektronen.
- Bromine (BR) heeft 7 valentie -elektronen.
- Totale valentie -elektronen:5 + (7 x 5) =40
2. Centraal atoom: Fosfor (P) is het minst elektronegatieve atoom, waardoor het het centrale atoom is.
3. Enkele bindingen: Sluit elk broomatoom aan op het fosforatoom met een enkele binding. Dit maakt gebruik van 10 elektronen (5 bindingen x 2 elektronen per binding).
4. resterende elektronen: Je hebt nog 30 elektronen over. Verdeel deze als eenzame paren rond elk broomatoom. Elk broomatoom heeft 3 eenzame paren (6 elektronen).
5. Formele ladingen: Bereken de formele lading op elk atoom om ervoor te zorgen dat de structuur het meest stabiel is. In dit geval hebben alle atomen een formele lading van 0.
Lewis -structuur van PBR5:
`` `
BR
/ \
BR BR
/ \ /
P Br
\ / \
BR BR
`` `
Sleutelpunten:
* Het fosforatoom is omgeven door 5 bindparen, waardoor het een sterisch nummer van 5 krijgt.
* De trigonale bipyramidale geometrie is te wijten aan de vijf elektronendomeinen rond het centrale atoom.
* De axiale bindingen (die direct op het fosforatoom wijzen) zijn iets langer dan de equatoriale bindingen.
Deze structuur is consistent met de experimenteel waargenomen geometrie van fosfor pentabromide.
 De sleutel tot het verminderen van de uitstoot van kooldioxide is gemaakt van metaal
De sleutel tot het verminderen van de uitstoot van kooldioxide is gemaakt van metaal Is zout altijd een ionische verbinding?
Is zout altijd een ionische verbinding?  Nieuwe techniek maakt real-time microscopie mogelijk bij hoge temperaturen en belasting
Nieuwe techniek maakt real-time microscopie mogelijk bij hoge temperaturen en belasting Welke van de volgende elementen is een stabiele neon of koolstofboorfluor?
Welke van de volgende elementen is een stabiele neon of koolstofboorfluor?  Wat heeft uranium te maken met ziekten?
Wat heeft uranium te maken met ziekten?
 Hoe te groeien Bloodworms
Hoe te groeien Bloodworms Slangen – waarom moesten het gigantische slangen zijn?
Slangen – waarom moesten het gigantische slangen zijn?  Ontbossing in Braziliaanse Amazone bereikt nieuw record in mei
Ontbossing in Braziliaanse Amazone bereikt nieuw record in mei Honderden soorten schimmels in diepe koraalecosystemen ontdekt door botanici
Honderden soorten schimmels in diepe koraalecosystemen ontdekt door botanici Mijnbouw drijft het moderne leven aan, maar kan land met littekens en vervuilde wateren achterlaten
Mijnbouw drijft het moderne leven aan, maar kan land met littekens en vervuilde wateren achterlaten
Hoofdlijnen
- Paranoia zal vernietigen:wanneer overschrijdt gezonde angst de grens in paranoia?
- Wat zorgt ervoor dat cellen muteren die kanker worden?
- Sucrose wordt gevormd wanneer glucose zich verbindt met fructose.
- Welk proces vindt plaats in de cellen van Spirulina dat niet bij de mens voorkomt?
- Disruptieve bio-engineering - verandert de manier waarop cellen met elkaar omgaan
- Welke twee dingen worden geabsorbeerd door de wortel haarcel?
- Proces van het synthetiseren van een RNA -streng uit een DNA -sjabloonstreng?
- Scholieren reageren vooral op één of twee buren tegelijk
- Maïsgenetica kan laten zien hoe gewassen zich aanpassen aan de klimaatverandering
- Had het vroege leven lang nodig, complexe moleculen om celachtige compartimenten te maken?

- Mechanisme dat verantwoordelijk is voor het maken van gehalogeneerde organische verbindingen bij fracken ontdekt
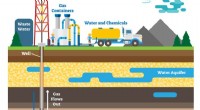
- Metalen stimuleren een veelbelovende methode om schadelijke kooldioxide onder de zee te begraven

- Wetenschappers creëren een kristal in een kristal voor nieuwe elektronische apparaten

- Verbeterde eiwitfunctie opent weg voor nieuw concept voor geneesmiddelontwikkeling
 Een nieuw facet van brandstofcelchemie
Een nieuw facet van brandstofcelchemie Nieuwe oliepalmkaart ter informatie van beleid en planning op landschapsniveau
Nieuwe oliepalmkaart ter informatie van beleid en planning op landschapsniveau Close-ups van de zon
Close-ups van de zon Waar wordt zwaveldioxide voor gebruikt?
Waar wordt zwaveldioxide voor gebruikt?  Hoge prijzen voor fossiele brandstoffen zijn goed voor de planeet:hoe u ze hoog kunt houden terwijl u rellen vermijdt of de armen pijn doet
Hoge prijzen voor fossiele brandstoffen zijn goed voor de planeet:hoe u ze hoog kunt houden terwijl u rellen vermijdt of de armen pijn doet Wat is de voornaamste kracht die het landschap vormgeeft?
Wat is de voornaamste kracht die het landschap vormgeeft?  EU-vrouwen verdienen 16 procent minder dan mannen:Eurostat
EU-vrouwen verdienen 16 procent minder dan mannen:Eurostat Wat is een bryophyllum -plant in Hindi genoemd?
Wat is een bryophyllum -plant in Hindi genoemd?
- Elektronica
- Biologie
- Zonsverduistering
- Wiskunde
- French | Italian | Spanish | Portuguese | Swedish | German | Dutch | Danish | Norway |

-
Wetenschap © https://nl.scienceaq.com

